Чем характеризуется кристаллическое строение металлов?
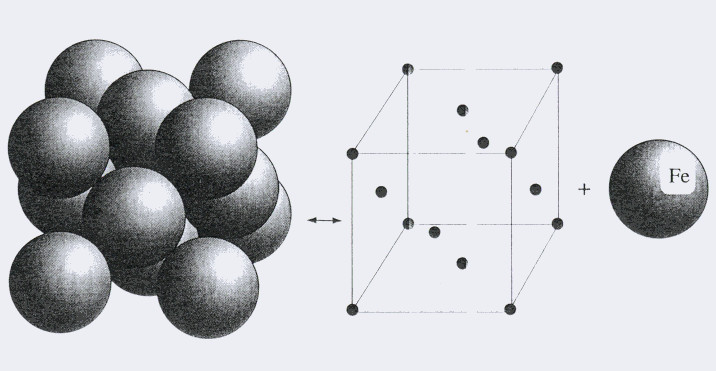
Кристаллическое строение металлов
Металлы — один из самых распространенных веществ в материальной культуре человека. Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений. В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.

В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники. В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций. Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.

Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.

Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.
Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.

Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов. Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.

Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.
схема кристаллической решетки.

Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.

Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.

Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму. Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.
Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны. Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;

Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.
Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения.
Основные сведения о металлах и сплавах
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого — в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Железный век продолжается. Примерно 9 /10 всех используемых человечеством металлов и сплавов – это сплавы на основе железа. Железа выплавляется в мире примерно в 50 раз больше, чем алюминия, не говоря уже о прочих металлах.
Было время, когда железо на земле ценилось значительно дороже золота. Советский историк Г. Арешян изучал влияние железа на древнюю культуру стран Средиземноморья. Он приводит такую пропорцию: 1 : 160 : 1280 : 6400. Это соотношение стоимостей меди, серебра, золота и железа у древних хеттов.
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3 раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения.
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами:
- специфический «металлический» блеск (хорошая отражательная способность и непрозрачность);
- высокая электропроводность;
- высокая теплопроводность;
- пластичность;
- отрицательный температурный коэффициент электропроводности (возрастание электросопротивления с повышением температуры).
Самыми распространенными в природе металлами являются алюминий, железо, кальций, натрий, калий, магний и титан.
Характерные свойства металлов обусловлены строением их атомов.
Из курса физики известно, что атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных частичек — электронов. В ядре атома находятся положительно заряженные частицы — протоны. Количество протонов равно количеству окружающих ядро электронов, т. е. атом в целом является электрически нейтральным.
Атом может терять или приобретать электроны. Тогда он превращается в электрически заряженный атом — ион. При избытке электронов ион заряжен отрицательно, при недостатке электронов — положительно.
Принадлежащие атому электроны разделяют на валентные (внешние), движущиеся по внешним орбитам, и внутренние, движущиеся по более близким к ядру орбитам.
Благодаря слабой связи внешних электронов с ядром в металлах всегда имеются электроны, подвергающиеся воздействию положительно заряженных ядер близлежащих атомов. Такие электроны называются свободными. Свободные электроны принадлежат не одному какому-либо ядру, а блуждают по всему металлу, вращаясь вокруг ядра то одного, то другого иона.
Наличием большого количества свободных электронов (называемых также коллективными или «электронный газ») и объясняются указанные выше характерные признаки металлов.
В отличие от металлов неметаллы, как правило, хрупки, лишены металлического блеска, имеют низкую тепло- и электропроводность. Электросопротивление неметаллов с повышением температуры понижается.
Все металлы в нормальных условиях являются твёрдыми телами (за исключением ртути) и представляют собой вещества, состоящие из большого числа мелких зёрен – кристаллов, упорядоченно расположенных друг относительно друга в пространстве. Этот порядок определяется понятием кристаллическая решётка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Основными типами кристаллических решёток являются:
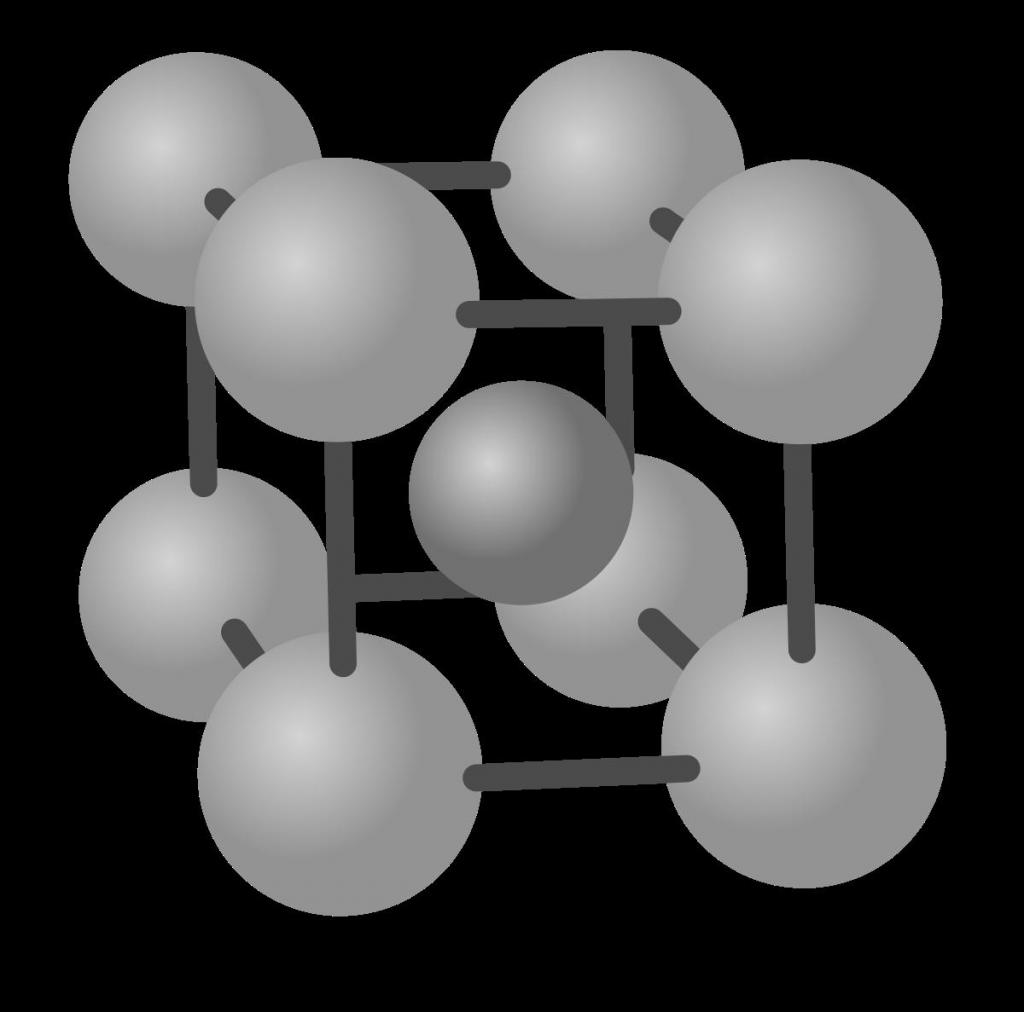
1) Объемно — центрированная кубическая (ОЦК) (см. рис.1 а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
2) Гранецентрированная кубическая (ГЦК) (см. рис. 1 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Cu, Al, Ag, Au, Feγ)
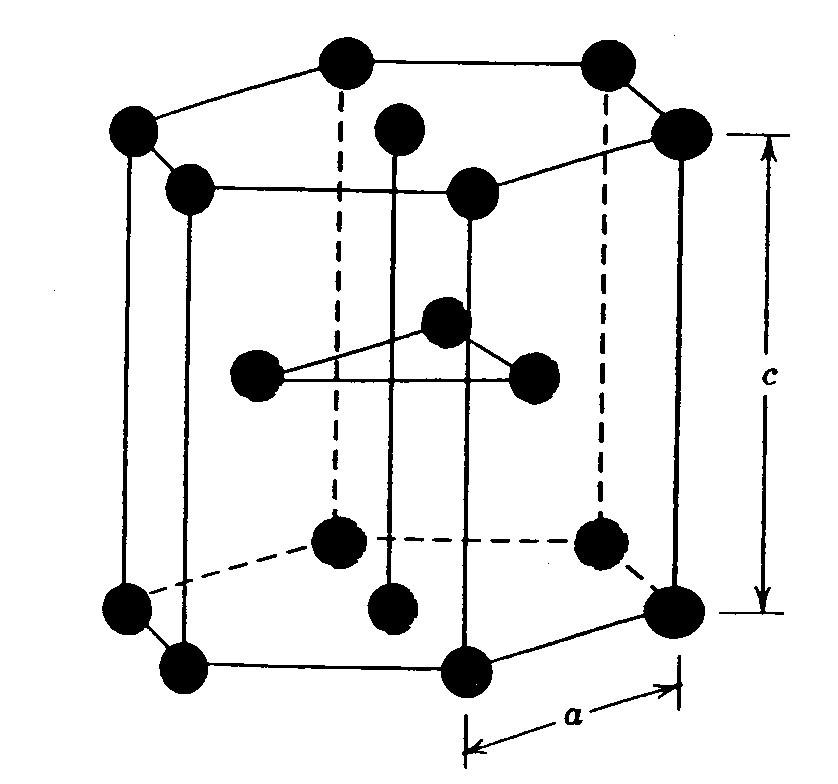
3) Гексагональная, в основании которой лежит шестиугольник:
простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
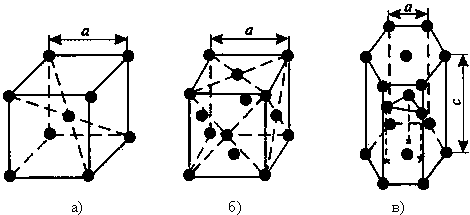
Рисунок 1 — Основные типы кристаллических решеток: а – объемно-центрированная кубическая;
б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропиейили полиморфизмом.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe): t 1539°С – ОЦК — Feσ.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают точечные, линейные и поверхностные дефекты.
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей (рис. 2).
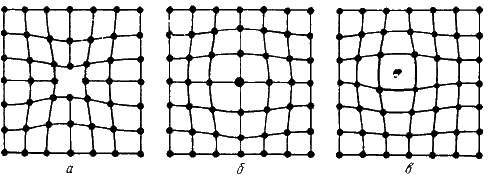
Рисунок 2 — Точечные дефекты
Вакансия – отсутствие атомов в узлах кристаллической решетки.
Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие.
Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях.
Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать.
Основными линейными дефектами являются дислокации.
Д 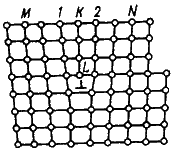 ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
Рисунок 3 — Искажения в кристаллической решетке при наличии краевой дислокации
Плотность дислокации в значительной мере определяет пластичность и прочность материала. С увеличением плотности дислокаций возрастает внутреннее механическое напряжение, изменяются оптические свойства, повышается электросопротивление металла. Дислокации ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки.
Дата добавления: 2015-11-20 ; просмотров: 5861 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кристаллическое строение металлов и их кристаллизация
Кристаллические структуры металлов
В природе существуют две разновидности твердых тел, различающиеся своими свойствами: кристаллические и аморфные.
Когда говорят о кристаллах, большинство из нас воображают некие правильные, ограниченные плоскими поверхностями твердые тела. Такое представление соответствует строению многих минералов: каждому ясно виден кристаллический характер горного хрусталя, всем хорошо знакомы ледяные кристаллы, которые образуются зимой на холодном оконном стекле, или прелестные кристаллики снежинки. Однако трудно представить, что вещи, с которыми мы постоянно имеем дело (нож, вилка, кастрюля, дверная ручка, молоток), тоже имеют кристаллическое строение. Но это так. Иногда, правда, можно заметить, что металлическое изделие состоит из множества мелких кристаллов, это обнаруживается, например, на поверхности излома. Кристаллы можно также наблюдать на поверхности расплавленного металла при его затвердевании и в так называемой усадочной раковине.
Еще в давние времена многие ученые высказывали предположение о том, что характерный внешний вид кристаллов соответствует их правильной внутренней структуре. Теорию строения кристаллов разрабатывали прославленный астроном Иоганн Кеплер (1571-1630), голландский физик и математик Христиан Гюйгенс (1629-1695), шведский химик Торнберн Улаф Бергман (1735-1784), французский минералог Рене Жюст Аюи (1745-1822). Они пытались связать закон постоянства углов между гранями кристаллов, который Николаус Сгено (1636-1686) сформулировал в 1669 г., исходя из внешней геометрии кристаллов, с их внутренней структурой.
Только в 1912 г., используя рентгеновские лучи, Макс фон Лауэ (1879-1960), Вальтер Фридрих (1883-1968) и Пауль Книппинг (1883-1935) смогли получить доказательство регулярного внутреннего строения кристаллов. Если атомы металла представить в виде крошечных мячей, то, регулярно распределив множество таких мячей в пространстве, мы получим упрощенную картину кристаллического строения металлов (рис. 1.17, в).
Определенное и закономерное расположение атомов в пространстве обусловливает то, что в кристалле каждый атом имеет одно и то же количество ближайших атомов-соседей, находящихся на одинаковом от него расстоянии.
Стремление атомов (ионов) металла расположиться как можно ближе друг к другу (поэтому металлы и обладают более высокой плотностью, чем неметаллы) приводит к тому, что число встречающихся комбинаций относительного расположения атомов металла в кристаллах невелико.
При описании правильной внутренней структуры кристаллов обычно пользуются понятием кристаллической решетки.
Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются частицы (атомы, ионы или молекулы), образующие кристалл (рис. 1.18).

Рис. 1.17. Упрощенная картина кристаллического строения металлов: а — излом меди; б — микроструктура доэвтектической стали с содержанием углерода
0,3 % (светлые участки — феррит, темноватые — перлит, увеличение — х250); в — кристаллическое строение металла при представлении его
атомов в виде мячей

Рис. 1.18. Схема расположения атомов металла в кристаллической решетке:
а — в плоскости; б — в пространстве
В основе кристаллической решетки лежит элементарная кристаллическая ячейка, представляющая собой наименьший объем кристалла, позволяющий судить об атомной структуре металла. Взяв большое число одинаковых кристаллических ячеек, имеющих вид параллелепипеда, с характерным для данной решетки расположением атомов и вплотную уложив эти ячейки в определенном объеме, сохраняя параллельность ребер и граней, получим пример строения идеального монокристалла.
Типы кристаллических ячеек у разных металлов различны, поэтому неодинаков и порядок расположения атомов в решетке.
Большинство металлов образуют кристаллические решетки, элементарными ячейками которых являются: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ) (рис. 1.19).
Как видно из рис. 1.19, в объемно-центрированной кубической решетке все атомы распределены в узлах ячейки, кроме одного, расположенного в центре объема куба. Такую решетку имеют следующие металлы: a-железо, вольфрам, иттрий, молибден, рубидий, калий, натрий, литий, титан, (3-титан, (3-цирконий, тантал, хром, ниобий, барий и др. В гранецентрированной к у б и —

Рис. 1.19. Типы элементарных ячеек: а — ОЦК; б — ГЦК; в — ГПУ
ческой решетке атомы находятся в узлах куба и в центре каждой грани. Этот тип решетки имеют металлы (у-железо, торий, свинец, скандий, никель, серебро, золото, платина, медь, кобальт и др.). В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Эту упаковку атомов имеют такие металлы, как гафний, магний, бериллий, цинк и др.
Расстояния между соседними атомами (а на рис. 1.19 и с в вертикальном направлении) в кристаллической решетке определяют ее параметры, измеряемые в ангстремах (1 А = 0,1 нм = 10 10 м). Об их незначительной величине можно судить по значению параметров. У большинства металлов периоды решеток меняются от 2,5 до 5,5 А.
Координационным числом (К) называется количество атомов, находящихся на наиболее близком и одинаковом расстоянии от любого произвольно выбранного атома в решетке. Координационное число для ОЦК-решетки равно К = 8 (атом в центре куба имеет 8 соседей, которые расположены на минимальном расстоянии, равном d = 0,5aj3; т.е. в вершинах куба). Для ГЦК-решетки координационное число равно К = 12 (каждый атом в узлах имеет по три ближайших соседа, распределенных в центрах граней на расстоянии d = 0,5aV2 от угловых). Гексагональная плотноупакованная решетка (рис. 1.20, в), для которой с/а — 1,633, имеет К = 12. Существуют также кубическая сложная многоатомная, ромбическая, алмазная и другие решетки металлов (табл. 1.10).
Таблица 1.10
Кристаллическая структура полиморфных металлов
Интервал температур устойчивого состояния, °С
Окончание табл. 1.10
Аллотропическая
Интервал температур устойчивого состояния, °С
Кристаллическая решетка
Кубическая сложная многоатомная
Ромбическая
Иногда одни и те же металлы имеют резкое отличие в свойствах и строении. Это связано с тем, что металл в зависимости от условий может иметь различную кристаллическую решетку. Способность материала образовывать несколько кристаллических структур (модификаций) одинакового состава называют полиморфизмом или аллотропией.
Различные модификации одного и того же вещества называются аллотропическими модификациями и обозначаются буквами греческого алфавита (а, (3, у, 8 и т.д.). Буква а обозначает модификацию металла, существующего при самой низкой температуре. Следующие буквы относятся к модификациям с более высокой температурой. Процесс аллотропического превращения происходит при постоянной температуре и сопровождается выделением скрытой теплоты кристаллизации при охлаждении (или поглощением при нагреве). Вследствие этого аллотропическое превращение отмечается на кривой охлаждения горизонтальной линией.
Температурным полиморфизмом обладают около тридцати металлов. Некоторые из них приведены в табл. 1.10. Из таблицы следует, что одна и та же решетка у железа (ОЦК) устойчива в двух интервалах температур. Высокотемпературное a-железо часто называют 8-желе- зом. Превращение модификации у в а сопровождается уменьшением координационного числа кристаллической решетки и компактности упаковки. Если бы при этом в значительной степени не уменьшался атомный радиус, то объем железа должен был бы увеличиваться на 9 %. На самом деле (благодаря уменьшению атомного радиуса) его увеличение составляет примерно 1 %. Структурные напряжения, вызванные даже таким незначительным изменением, имеют большое значение.
При 768 °С на кривой охлаждения наблюдается остановка, связанная не с перестройкой решетки, а с изменением магнитных свойств. Выше 768 °С a-железо немагнитно (немагнитное железо называют иногда (3-железо), а ниже этой температуры — ферромагнитно (рис. 1.20).
Полиморфизм на практике имеет большое значение. Это явление открывает возможность в значительной степени изменять свойства используемых в технике материалов.
Наряду с температурным известен полиморфизм под влиянием температуры и давления. При очень больших давлениях в железе обнаруживается низкотемпературная модификация с гексагональной решеткой ГПУ. Рост давления может приводить к превращению при низких температурах менее плотноупакованных модификаций в плотноупако- ванные структуры.
В кристаллической решетке монокристалла плотность расположения атомов по разным кристаллографическим плоскостям неодинакова. Как следствие, многие свойства кристаллов (механические, химические, магнитные, физические) в разных направлениях различны. Свойства же, определяемые всем объемом вещества (плотность,

Рис. 1.20. Кривая охлаждения железа теплоемкость, температура плавления), независимо от направлений одинаковы. Различие свойств в разных направлениях кристаллографических плоскостей называется анизотропией.
Если образец состоит из одного кристалла (монокристалла), то анизотропия свойств проявляется в самой большой степени. Напротив, в поликристалле, состоящем из большого числа различно ориентированных зерен, она практически сводится к нулю. В этом случае принято говорить, что металл изотропен, т.е. его свойства во всех направлениях одинаковы. В поликристаллических веществах анизотропии свойств добиваются созданием преимущественно одинаковой ориентировки многих зерен в том или ином направлении. Преимущественно (но не абсолютно) одинаковая ориентировка зерен называется текстурой. В металлах текстуры образуются в результате деформации и отжига деформированных изделий, обработки металлов в электрических и магнитных полях. Текстурованные изделия используют, например, при производстве электротехнических сталей.
Изменение прочности и пластичности монокристаллов различных металлов в зависимости от направления можно наблюдать на примере меди. Так, прочность и пластичность монокристалла меди изменяется от направления в следующих пределах: ав = 180. 350 МПа, 8 = 10. 50 %, а для поликристаллической меди ав = 250 МПа, 8 = 40 %.
Кристаллическое строение металлов. Кристаллическая решетка металлов. Металлы в периодической системе Менделеева

Из школьного курса химии известно, что все элементы, которые сгруппированы по определенным правилам в периодическую таблицу Менделеева, можно условно разделить на металлы и неметаллы. В этой статье будет рассказано о кристаллическом строении металлов, их физико-химических свойствах, а также о дефектах на атомном уровне, которые в них присутствуют.
Периодическая таблица и металлы
В XIX веке благодаря своему блестящему уму и многим годам труда Дмитрий Иванович Менделеев составил таблицу, собрав в нее все известные на то время химические элементы. Каждому из них в таблице отведено определенное положение в соответствии с числом протонов в атомном ядре. Вся таблица делится на 7 периодов (горизонтальные строки) и 8 групп (вертикальные строки). Чем больше период, тем больше радиус атома соответствующего элемента, и тем на более высоких орбиталях расположены его валентные электроны. Наоборот, чем старше группа (движение по таблице слева направо), тем больше валентных электронов находится на последней орбитали и тем меньше радиус атома.
Любой элемент таблицы можно условно отнести либо к металлам, либо к неметаллам. Металлы расположены по левую сторону от диагонали бор (B) — полоний (Po). Если взглянуть на таблицу, то можно сразу понять, что количество металлов в несколько раз превышает число неметаллов.
Что такое металл и чем он отличается от неметалла?
Иными словами, как можно понять, что перед нами находится металлический материал? Ответы на все эти вопросы можно получить, если рассмотреть уникальные свойства металлов. К ним относятся следующие основные:
- Наличие металлического блеска при полировке поверхности. Все металлы блестят, в своем большинстве они имеют серый цвет, однако, некоторые металлы обладают специфической окраской, например, висмут розовый, медь красноватая, а золото желтое.
- Высокая теплопроводность и электропроводность. При комнатной температуре наиболее высокие показатели для этих физических свойств характерны для меди и серебра.
- При комнатной температуре практически все металлы находятся в твердом агрегатном состоянии материи. Исключение составляет ртуть, которая плавится уже при -39 o C.
- Будучи в твердом состоянии, металлы кристаллическим строением характеризуются. Если расплав рассматриваемого материала слишком быстро охлаждать, то он приобретает аморфную структуру, в которой все же сохраняется ближний порядок.
- Температуры плавления и плотности металлов варьируются в широких пределах. Так, элемент вольфрам является самым тугоплавким (3410 o C). Самым же тяжелым считается осмий (в 22,6 раза плотнее воды), а самым легким — литий (почти в 2 раза менее плотный, чем вода).
- Все металлы химически активны. Поскольку они обладают низкой электроотрицательностью, то в химических реакциях их атомы отдают электроны и превращаются в положительно заряженные ионы (катионы).

Выше в списке были перечислены основные свойства металлов, которые их отличают от неметаллических материалов. Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Какие металлы бывают?
Металлы в периодической системе Менделеева делятся на несколько групп. Перечислим и кратко охарактеризуем их:
- Щелочные. Эти металлы имеют всего 1 валентный электрон, они чрезвычайно химически активны, имеют низкую плотность и являются отличными проводниками тепла и электричества. Примерами их являются литий, натрий и калий.
- Щелочноземельные. К ним относятся кальций, магний, стронций. Эти металлы имеют 2 валентных электрона, поэтому они также являются химически активными.
- Переходные. Это металлы с переменной валентностью, которые имеют пустые или полупустые орбитали d и f типа. Это самая многочисленная группа металлов. К ним относятся титан, ванадий, хром, никель, вольфрам, осмий, золото и многие другие.
- Лантаноиды и актиноиды. Большая часть этих элементов является нестабильными и проявляет различную степень радиоактивности.
- Постпереходные. Это те элементы, после которых по периоду идут металлоиды, а затем неметаллы. Самыми известными из них являются свинец, алюминий и олово.
Черные и цветные металлы
Выше была приведена классификация рассматриваемых элементов в соответствии с их электронным строением и положением в периодической системе. Помимо нее, существует еще одно разделение, которое не связано с атомным строением — это понятие о черных и цветных металлах.
Черным является железо и все сплавы с его участием. Примеры цветных металлов — это алюминий, золото, серебро, медь и другие, а также сплавы, которые не содержат железа. Причина такого разделения проста, черные металлы являются дешевыми и недолговечными (разрушаются в результате коррозии, ржавеют). Наоборот, цветные металлы характеризуются способностью образовывать пленки оксидные, которые предотвращают основную массу материала от дальнейшего химического разрушения.
Металлическая связь
Изучая атомно-кристаллическое строение металлов, следует сказать несколько слов об особенностях химической связи между рассматриваемыми элементами. Поскольку электроотрицательность металлов низкая, то, объединяясь в кристаллическую решетку, каждый атом отдает один или несколько валентных электронов. Эти электроны слабо связаны с ядром, поэтому они легко от него отрываются уже при комнатных температурах.
Совокупность валентных электронов, которые свободно движутся в пространстве между ионными остовами в кристаллической решетке металлов, называется электронным газом. Благодаря ему кусок металла легко проводит тепло и электричество.
Электрическое поле положительно заряженных ионных остовов компенсируется отрицательным полем «размазанного» по объему металла электронного газа. Такая связь называется металлической. Она кардинальным образом отличается от других типов химической связи. Например, в ковалентной атомы не отдают электроны в межатомное пространство, они становятся общими только для двух атомов. Наоборот, в ионной связи один атом полностью лишает второго валентных электронов, присоединяя их к себе, и приобретая отрицательный заряд.
Кристаллическое строение металлов. Типы кристаллических решеток
Когда металл образует твердую структуру, то все его атомы стремятся занять такие положения в пространстве относительно друг друга, чтобы они соответствовали минимуму потенциальной энергии. Этому минимуму соответствует кристаллическая решетка.
Под кристаллической решеткой понимают такую пространственную атомную структуру, которая может быть получена, если известны координаты ограниченного числа ее атомов и вектора их трансляции в пространстве. Указанное число атомов называется базисом решетки, а их положения образуют так называемую элементарную ячейку.
Все металлы кристаллизуются в трех основных типах решеток:
- гранецентрированная кубическая (ГЦК);
- объемно-центрированная кубическая (ОЦК);
- гексагональная плотноупакованная (ГПУ).
Благодаря кристаллическому строению металлы обладают такими свойствами, как пластичностью, упругостью и металлическим блеском.
Решетки ГЦК, ОЦК, ГПУ
Изучая кристаллическое строение металлов, охарактеризуем подробнее каждый тип кристаллической решетки. Начнем с ГЦК. Она показана ниже на рисунке.
Как видно, это решетка представляет собой кубик, в котором атомы расположены в его вершинах и в центрах всех шести граней. Применяя методы кристаллографии, несложно показать, что для получения такой решетки в пространстве достаточно всего четырех атомов и векторов трансляций, совпадающих с ребрами куба.
Примерами металлов, которые кристаллизуются в ГЦК, являются алюминий, медь, золото и серебро. Железо образует ГЦК решетку только при высоких температурах.
ОЦК решетка показана ниже.
Мы видим, что она соответствует кубику, в вершинах и в центре которого находится атом. Всего два атома необходимо, чтобы в прямоугольных декартовых координатах построить ОЦК решетку. Такие металлы, как ванадий, тантал, ниобий, вольфрам имеют именно эту кристаллическую структуру.
Наконец, ГПУ решетка. Она представлена ниже на рисунке.
Эта кристаллическая решетка металлов отличается от двух предыдущих тем, что она в пространстве образует не куб, а правильную шестиугольную призму, которая состоит из шести атомов. В данной структуре кристаллизуются такие элементы, как титан, цирконий, магний и кобальт.
Понятие об индексах Миллера
Чтобы удобно было описывать численно показанные выше пространственные решетки, в кристаллографии используют так называемые индексы Миллера. Они представляют собой наборы чисел, которые позволяют точно определить положение в пространстве данного атомного ряда или атомной плоскости. По этим числам судят о поверхностных энергиях, о способности металлов проявлять пластические свойства. Например, в ГЦК решетке краевые дислокации движутся по плоскостям (1,1,1) (эти плоскости являются максимально плотноупакованными, нормалью к ним будут диагонали куба).
Дефекты в металлах
Выше мы показали идеальную ситуацию, когда все атомы находятся на своих местах, и пространственную структуру всего металлического куска можно получить с помощью простых трансляций элементарной ячейки. В действительности же существуют множество несовершенств кристаллического строения металлов. Они называются дефектами.
Все дефекты можно по геометрическому признаку отнести к одному из четырех типов:
- Точечные. Вакансии, межузельные атомы, наличие внедренных атомов других элементов, создающих микроскопические локальные напряжения.
- Линейные. Дислокации — обрывы кристаллических плоскостей, которые обеспечивают пластичность всех металлов.
- Плоские — границы зерен. Любой металл состоит из множества монокристаллов, которые друг с другом соединены в различной ориентации через межзеренные границы.
- Объемные. Поры, различные фазовые включения, которые упрочняют металл и снижают его пластичность.
Влияние дефектов на свойства
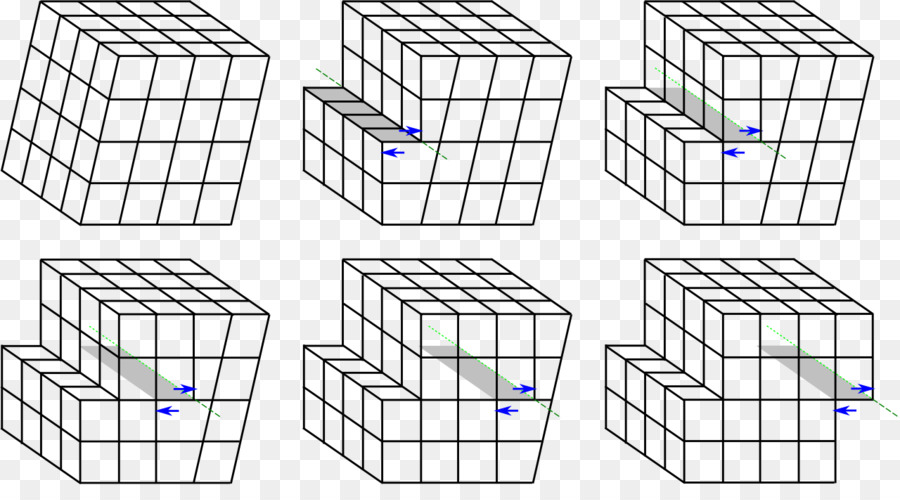
Как правило, дефекты кристаллического строения металлов приводят к снижению их теплопроводности и электропроводности, материал становится более прочным и менее пластичным. Ярким примером является сталь, которая за счет междоузельных атомов углерода и наличия разных фаз (цементита, графита) в кристаллической решетке железа, значительно прочнее, чем чистый металл.
С развитием нанотехнологий влияние дефектов на свойства металлов может быть неоднозначным. Так, с уменьшением размера зерна может наблюдаться увеличение пластичности материала, что связано с появлением совершенно иного механизма пластической деформации — зернограничного проскальзывания, которое по своей сути отличается от дислокационного.
Реальный кристалл металла
Какой бы химический металлический элемент не рассматривался, в действительности он представляет собой твердое вещество, в котором маленькие монокристаллы (зерна) соединены друг с другом в различных ориентациях. Такая структура образует поликристалл. В нем, помимо границ зерен, присутствуют дефекты всех четырех типов, включая примеси таких неметаллов, как кислород, азот и водород. Последний из-за своих размеров легко проникает в любую кристаллическую решетку, образует с ее ионами твердые фазы, которые приводят к охрупчиванию металла, что является одной из актуальных проблем металловедения.
Кристаллическое строение металлов
Особенностью строения металлов является кристаллическая структура, основу которой составляет кристаллит (зерно). Кристаллит построен из элементарных кристаллических ячеек (решеток). Элементарная кристаллическая решетка имеет в своих узлах атомы (ионы), и весь кристаллит состоит из набора множества элементарных кристаллических ячеек. На рис. 2.2 изображена отдельная кристаллическая ячейка, представляющая собой параллелепипед, построенный на векторах а, Ъ, с, модули которых равны периодам идентичности.
Ячейка характеризуется, кроме ребер а, Ъ, с, еще и углами а, р, у между ребрами. В целом эти шесть величин определяют ячейку количественно и называются ее параметрами.
Одним из свойств, которыми обладает кристаллическая решетка, является симметрия — свойство решетки совпадать с собой при пространственных перемещениях. Самой высокой симметрией обладает кубическая ячейка, у которой все ребра равны: а = Ь = с, а углы, соответственно, а = р = у = 90°.
В узлах кристаллической решетки металлов расположены положительные ионы металла. Между ними движутся электроны, отщепившиеся от атомов при образовании ячейки. Эти электроны играют роль «цемента», удерживая вместе положительные ионы, в противном случае ячейка распалась бы под действием сил отталкивания между ионами. Одновременно и электроны удерживаются

Рис. 2.2. Отдельная кристаллическая ячейка
положительными ионами в пределах кристаллической ячейки и не могут ее покинуть.
В металлах наиболее распространенными являются следующие типы кристаллических решеток: гексагональная плотноупакован- ная (ГПУ), кубическая гранецентрированная (ГЦК), кубическая объемно-центрированная (ОЦК).
Структура ГПУ называется плотноупакованной, потому что она обладает максимальной плотностью упаковки — каждый атом окружен двенадцатью ближайшими соседями (рис. 2.3): шесть атомов находятся в одной и той же плоскости и по три атома в верхней и нижней плоскостях. Такой решеткой обладают следующие металлы: бериллий, магний, кобальт, цинк, кадмий, рений, осмий.
ГЦК также является плотноупакованной решеткой (рис. 2.4). В ней атомы (ионы) занимают все вершины куба и центр каждой грани. В этой решетке каждый атом также имеет 12 соседних атомов. Решетку гранецентрированного куба имеют алюминий, медь, никель, свиней, платина, золото, серебро, железо (при температуре от 720 до 910 °С).
Решетка ОЦК обладает менее плотной упаковкой атомов (рис. 2.5). Эта элементарная ячейка представляет собой куб с атомами (ионами) в каждой вершине и в центре куба. Здесь каждый

Рис. 2.3. Гексагональная плотноупакованная решетка (ГПУ)

Рис. 2.4. Кубическая гранецентрированная решетка (ГЦК)

Рис. 2.5. Кубическая объемно-центрированная решетка (ОЦК)
атом окружен восемью соседями. Решеткой объемно-центрирован- ного куба характеризуются следующие металлы: литий, натрий, калий, ванадий, вольфрам, ниобий, железо (при температуре ниже 720 и выше 910 °С).
Три вышеприведенных типа элементарных кристаллических решеток имеют большинство металлов, но не все. Так марганец имеет простую кубическую решетку, а висмут, сурьма — ромбоэдрическую и т.д.
Основными параметрами кристаллических решеток являются кратчайшие межатомное расстояние d, атомный радиус га и атомный объем Va.
В табл. 2.1 приведены типы структур и основные параметры кристаллических решеток наиболее распространенных металлов.
2.1. Структуры и параметры кристаллической решетки металлов
Чем характеризуется кристаллическое строение металлов?
Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном, переходы между которыми (так называемые фазовые переходы) сопровождаются скачкообразными изменениями свободной энергии  где
где  — внутренняя энергия; Т — температура;
— внутренняя энергия; Т — температура;  — энтропия), энтропии, плотности и других физических свойств. Четвертым агрегатным состоянием часто называют плазму — сильно ионизированный газ (т. е. газ заряженных частиц — ионов, электронов), образующийся при высоких температурах (свыше 108 К). Однако это утверждение неточно, так как между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющимся на больших расстояниях.
— энтропия), энтропии, плотности и других физических свойств. Четвертым агрегатным состоянием часто называют плазму — сильно ионизированный газ (т. е. газ заряженных частиц — ионов, электронов), образующийся при высоких температурах (свыше 108 К). Однако это утверждение неточно, так как между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющимся на больших расстояниях.
Реализация того или иного агрегатного состояния вещества зависит главным образом от температуры и давления, при которых оно находится (рис. 5). Важной характеристикой является отношение
средней потенциальной энергии взаимодействия атомов  к их средней кинетической энергии
к их средней кинетической энергии  Для газов
Для газов  , для жидкостей
, для жидкостей  Для твердых тел
Для твердых тел  .
.
В газах межмолекулярные (атомы в газах объединены в молекулы N, и т. д.) расстояния большие, молекулы практически не взаимодействуют друг с другом и, свободно двигаясь, заполняют весь возможный объем. Таким образом, для газа характерно отсутствие собственного объема и формы.

Рис. 5. Диаграмма состояния вещества в зависимости от давления и температуры

Рис. 6. Кристаллическая решетка (выделена элементарная ячейка с параметрами 
Жидкости и твердые тела относят к конденсированному состоянию вещества. В отличие от газообразного состояния у вещества в конденсированном состоянии атомы расположены ближе друг к другу, что приводит к их более сильному взаимодействию и, как следствие этого, жидкости и твердые тела имеют постоянный собственный объем. Для теплового движения атомов в жидкости характерны малые колебания атомов вокруг равновесных положений и частые перескоки из одного равновесного положения в другое. Это приводит к наличию в жидкости только так называемого ближнего порядка в расположении атомов, т. е. некоторой закономерности в расположении соседних атомов на расстояниях, сравнимых с межатомными. Для жидкости в отличие от твердого тела характерно такое свойство, как текучесть.
Атомы в твердом теле, для которого в отличие от жидкого тела характерна стабильная, постоянная собственная форма, совершают только малые колебания около своих равновесных положений. Это приводит к правильному чередованию атомов на одинаковых расстояниях для сколь угодно далеко удаленных атомов, т. е. существования так называемого дальнего порядка в расположении атомов. Такое правильное, регулярное расположение атомов в твердом теле, характеризующееся периодической повторяемостью в трех измерениях (рис. 6), образует кристаллическую решетку, а тела, имеющие кристаллическую решетку, называют твердыми телами. Кроме того, существуют аморфные тела (стекло, воск и т. д.). В аморфных телах атомы совершают малые колебания вокруг хаотически
расположенных равновесных положений, т. е. не образуют кристаллическую решетку. Аморфное тело находится с термодинамической точки зрения в неустойчивом (так называемом метастабильном) состоянии и его следует рассматривать как сильно загустевшую жидкость, которая с течением времени должна закристаллизоваться, т. е. атомы в твердом теле должны образовать кристаллическую решетку и превратиться в истинно твердое тело.
Для аморфного тела характерна изотропия свойств (одинаковые свойства по разным направлениям), а также отсутствие точки плавления, т. е. при повышении температуры аморфное тело размягчается Эти особенности вызваны отсутствием у аморфного тела дальнего порядка в расположении атомов, однако ближний порядок имеется. Таким образом, аморфное тело правильнее рассматривать как жидкость в переохлажденном, метастабильном состоянии с очень высоким коэффициентом вязкости.

Рис. 7. Схема сил взаимодействия (а) и потенциальной энергии взаимодействия (б) между атомами в зависимости от расстояния
Аморфное состояние образуется при быстром  и более) охлаждении расплава. Например, при охлаждении ряда сплавов из жидкого состояния образуются так называемые металлические стекла, обладающие специфическими физико-механическими свойствами.
и более) охлаждении расплава. Например, при охлаждении ряда сплавов из жидкого состояния образуются так называемые металлические стекла, обладающие специфическими физико-механическими свойствами.
Какие силы удерживают атомы в твердом теле. Между атомами, образующими кристаллическое твердое тело, существуют силы притяжения, которые уравновешиваются на расстояниях порядка  см силами отталкивания (рис. 7, а).
см силами отталкивания (рис. 7, а).
Соответственно при  см потенциальная энергия взаимодействия атомов имеет минимальное значение (рис. 7, б). Таким образом при
см потенциальная энергия взаимодействия атомов имеет минимальное значение (рис. 7, б). Таким образом при  атомы притягиваются, при
атомы притягиваются, при  — отталкиваются, при
— отталкиваются, при  находятся в устойчивом положении. Существование атомно-кристаллической решетки в твердых телах с межатомным расстоянием порядка
находятся в устойчивом положении. Существование атомно-кристаллической решетки в твердых телах с межатомным расстоянием порядка  см объясняется тем, что минимум потенциальной энергии системы достигается именно тогда, когда атомы регулярно, периодически расположены в пространстве. В самом общем случае при данной температуре Т расположение атомов в кристаллической решетке, т. е. структура кристаллов, соответствует не минимуму потенциальной энергии
см объясняется тем, что минимум потенциальной энергии системы достигается именно тогда, когда атомы регулярно, периодически расположены в пространстве. В самом общем случае при данной температуре Т расположение атомов в кристаллической решетке, т. е. структура кристаллов, соответствует не минимуму потенциальной энергии  (точнее внутренней энергии
(точнее внутренней энергии  но в данном рассмотрении пренебрегаем кинетической энергией атомов), а минимуму свободной энергии
но в данном рассмотрении пренебрегаем кинетической энергией атомов), а минимуму свободной энергии  . Это обстоятельство, т. е. наличие энтропийного члена Т ответственно, в частности, за многообразие встречающихся у элементов и их соединений кристаллических структур.
. Это обстоятельство, т. е. наличие энтропийного члена Т ответственно, в частности, за многообразие встречающихся у элементов и их соединений кристаллических структур.
Природу отталкивания атомов в различных твердых телах можно считать одинаковой: на больших расстояниях основную роль играют кулоновские силы отталкивания положительных ионов (ядер), а на меньших расстояниях главную роль играют силы отталкивания, возникающие вследствие перекрытия заполненных электронных оболочек сближенных атомов.
Силы притяжения (силы связи) в твердых телах существенно отличаются по своей природе. Обычно рассматривают четыре основных типа связи в твердых телах: металлическую, ионную, ковалентную и связь Ван-дер-Ваальса. В большинстве случаев связи в твердых телах носят смешанный характер. В металлах и сплавах определяющее значение имеет металлический тип связи. Связь в металлах обусловлена взаимодействием положительных ионов с коллективизированными электронами. Свободные электроны проводимости, находясь между ионами, как бы «стягивают» их, компенсируя силы отталкивания. У ряда металлов (например, переходных) определенный вклад вносит также ковалентная связь, при которой объединяются два атома, временно передающие друг другу валентный электрон и удерживаемые поэтому силами электростатического притяжения. При ионной связи соседние атомы уже постоянно обменялись электронами.