Какие частицы находятся в узлах решетки металла?
Какие частицы находятся в узлах решетки металла?
Взаимосвязь типа химической связи с видом кристаллической решетки
Вещества и кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток:

Ионная решетка

Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.
Свойства ионных кристаллов :
· твердые, но хрупкие;
· отличаются высокими температурами плавления;
· нелетучи, не имеют запаха;
· расплавы ионных кристаллов обладают электропроводностью;
· многие растворимы в воде; при растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Металлическая решетка

Характерна для веществ с металлической связью. Реализуется в простых веществах — металлах и их сплавах. В узлах решетки — атомы и катионы металла, при этом электроны металла обобществляются и образуют так называемый электронный газ, который движется между узлами решетки, обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и обусловлены свойства веществ с металлической решеткой:
· тепло- и электропроводность;
· обладают металлическим блеском;
· высокие температуры плавления.
Атомная решетка

В узлах решетки — атомы, связанные ковалентными связями. Химическая связь — ковалентная полярная или неполярная. Атомная кристаллическая решетка характерна для углерода (алмаз, графит), бора, кремния, германия, оксида кремния SiO2(кремнезем, кварц, речной песок), карбида кремния SiC (карборунд), нитрида бора BN.
Свойства веществ с атомной решеткой :
· высокие температуры плавления;
Молекулярная решетка

В узлах — молекулы веществ, которые удерживаются в решетке с помощью слабых межмолекулярных сил.
Молекулярное строение имеют:
o все органические вещества (кроме солей);
o вещества — газы и жидкости;
o легкоплавкие и летучие твердые вещества, в молекулах которых ковалентные связи (полярные и неполярные).
Подобные вещества часто имеют запах.
Кристаллические решетки, вид связи и свойства веществ
Т ип решетки
Виды частиц в узлах решетки
Вид связи между частицами
Примеры веществ
Физические свойства веществ
Ионная связь — прочная
Соли, галогениды (IA,IIA), оксиды и гидроксиды щелочных и щел.-зем. металлов
Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток
1. Ковалентная неполярная — очень прочная
2. Ковалентная полярная связь — очень прочная
Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si)
Сложные вещества: оксид алюминия (Al2O3), оксид кремния (IV) SiO2
Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде
Между молекулами — слабые силы межмолекулярного притяжения, внутри молекул — прочная ковалентная связь
При обычных условиях — газы, жидкости или летучие твердые вещества:
Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость
Металлическая связь — разной прочности
Металлы и сплавы
Ковкие, обладают блеском, пластичностью, тепло- и электропроводны
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения.
Для большинства веществ характерна способность в зависимости от условий находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном.
Например, вода при нормальном давлении в интервале температур 0-100 o C является жидкостью, при температуре выше 100 о С способна существовать только в газообразном состоянии, а при температуре менее 0 о С представляет собой твердое вещество.
Вещества в твердом состоянии различают аморфные и кристаллические.
Характерными признаками аморфных веществ является отсутствие четкой температуры плавления: их текучесть плавно увеличивается с ростом температуры. К аморфным веществам относятся такие соединения, как воск, парафин, большинство пластмасс, стекло и т.д.
Все же кристаллические вещества обладают конкретной температурой плавления, т.е. вещество с кристаллическим строением переходит из твердого состоянии в жидкое не постепенно, а резко, при достижении конкретной температуры. В качестве примера кристаллических веществ можно привести поваренную соль, сахар, лед.
Разница в физических свойствах аморфных и кристаллических твердых веществ обусловлена прежде всего особенностями строения таких веществ. В чем заключается разница между веществом в аморфном и кристаллическом состоянии, проще всего понять из следующей иллюстрации:
Как можно заметить, в аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкорасположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях. Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
Кристаллическая решетка алмаза как пример атомной решетки
В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой
в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток.
К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4 + ), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
 Кристаллическая решетка хлорида натрия как пример ионной решетки
Кристаллическая решетка хлорида натрия как пример ионной решетки
Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO4 2- , NH4 + , PO4 3- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Металлическая кристаллическая решетка
Такие особенности строения приводят к тому, что металлы хорошо проводят тепло и электрический ток, часто обладают высокой пластичностью (ковкостью).
Разброс значений температур плавления металлов очень велик. Так, например, температура плавления ртути составляет примерно минус 39 о С (жидкая в обычных условиях), а вольфрама — 3422 °C. Следует отметить, что в обычных условиях все металлы, кроме ртути, являются твердыми веществами.
Какие частицы находятся в узлах решетки металла?













Последнее обновление
4 апреля 2020г.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное.
Чтобы рассматривать данную тему необходимо знать:
Электроотрицательность — это способность атома смещать к себе общую электронную пару. (Самый электроотрицательный элемент — фтор.)
Кристаллическая решетка — трехмерное упорядоченное расположение частиц.
Различают три основных типа химических связей: ковалентную, ионную и металлическую.
Металлическая связь характерна для металлов, которые содержат небольшое количество электронов на внешнем энергетическом уровне (1 или 2, реже 3). Эти электроны легко теряют связь с ядром и свободно перемещаются по всему куску металла, образуя «электронное облако» и обеспечивая связь с положительно заряженными ионами, образовавшимися после отрыва электронов. Кристаллическая решетка — металлическая. Это обуславливает физические свойства металлов: высокую тепло- и электропроводность, ковкость и пластичность, металлический блеск.
Ковалентная связь образуется за счет общей электронной пары атомов неметаллов, при этом каждый из них достигает устойчивой конфигурации атома инертного элемента.
Если связь образуют атомы с одинаковой электроотрицательностью, то есть разница электроотрицательности двух атомов равна нулю, электронная пара располагается симметрично между двумя атомами и связь называется ковалентной неполярной.
Если связь образуют атомы с разной электроотрицательностью, причем разница в электроотрицательности двух атомов лежит в интервале от нуля примерно до двух (чаще всего это разные неметаллы), то общая электронная пара смещается к более электроотрицательному элементу. На нем возникает частично отрицательный заряд (отрицательный полюс молекулы), а на другом атоме — частично положительный заряд (положительный полюс молекулы). Такая связь называется ковалентной полярной.
Если связь образуют атомы с разной электроотрицательностью, причем разница в электроотрицательности двух атомов больше двух (чаще всего это неметалл и металл), то считают, что электрон полностью переходит к атому неметалла. В результате этот атом становится отрицательно заряженным ионом. Атом, отдавший электрон, — положительно заряженным ионом. Связь между ионами называется ионной связью.
Соединения с ковалентной связью имеют два типа кристаллических решеток: атомные и молекулярные.
В атомной кристаллической решетке в узлах находятся атомы, соединенные прочной ковалентной связью. Вещества с такой кристаллической решеткой имеют высокие температуры плавления, прочны и тверды, практически нерастворимы в жидкостях. например, алмаз, твердый бор, кремний, германий и соединения некоторых элементов с углеродом и кремнием.
В молекулярной кристаллической решетке в узлах находятся молекулы, соединенные слабым межмолекулярным взаимодействием. Вещества с такой решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, из растворы практически не проводят электрический ток. Например, лед, твердый оксид углерода (IV) твердые галогеноводороды, твердые простые вещества, образованные одно-(благородные газы), двух- (F2, Cl2, Br2, I2, H2, O2, N2), трех-(О3), четырех- (Р4), восьми- (S8) атомными молекулами. Большинство кристаллических органических соединений имеют молекулярную решетку.
Соединения с ионной связью имеют ионную кристаллическую решетку, в узлах которой чередуются положительно и отрицательно заряженные ионы. Вещества с ионной решеткой тугоплавки и малолетучи, имеют сравнительно высокую твердость, но хрупки . Расплавы и водные растворы солей и щелочей проводят электрический ток.


Примеры заданий
1. В какой молекуле ковалентная связь «элемент — кислород» наиболее полярна?
Решение:
Полярность связи определяется разностью электроотрицательности двух атомов (в данном случае элемента и кислорода). Сера, азот и хлор находятся рядом с кислородом, следовательно их электроотрицательности отличаются незначительно. И только водород находится на отдалении от кислорода, значит разница в электроотрицательности будет большая, и связь будет наиболее полярна.
Ответ: 4)
2. Водородные связи образуются между молекулами
1) метанола 2) метаналь 3) ацетилена 4) метилформиата
Решение:
В составе ацетилена вообще нет сильноэлектроотрицательных элементов. Метаналь Н2СО и метилформиат НСООСН3 не содержат водорода, соединенного с сильноэлектроотрицательным элементом. Водород в них соединен с углеродом. А вот в метаноле СН3ОН между атомом водорода одной гидроксогруппы и атомом кислорода другой молекулы возможно образование водородной связи.
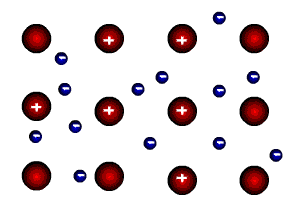
Какие частицы находятся в узлах кристаллической решетки металлов?
![]()
В узлах кристаллической решетки металлов находятся положительные ионы и атомы, а валентные электроны находятся в движении, они как бы являются общими для всей кристаллической решетки.
Валентные электроны притягиваются положительными ионами металлов, находящимися в узлах. За счет этих валентных электронов, с одной стороны, достигается стабильность кристаллической решетки металлов, а с другой, становятся возможными типично металлические свойства: хорошая тепло- и электропроводность, ковкость и пластичность металлов.
![]()
Строение кристаллической решетки металлов довольно простое, в ее узлах находятся соответствующие положительно заряженные атомы этого металла, иначе говоря ионы. Вокруг каждого иона, ядра атома металла вращаются электроны, но связь между электронами, вращающимися на внешних орбитах и ядром ослаблена и эти электроны легко могут перемещаться между узлов кристаллической решетки, что обусловливает как электропроводность металлов, так и их теплопроводность, а также такое специфическое свойство как пластичность. Эти относительно свободные электроны, которые можно считать принадлежащими сразу группе атомов, называются электронным газом.

![]()
Мы привыкли видеть, что есть ядро, в котором находится протон, а вокруг него по орбиталям вращаются электроны. Но в случае с металлами ситуация может выглядеть чуть иначе. Металлы создают кристаллическую решетку, где на вершинах находится протоны. А электроны двигаются в пространстве между ними беспорядочно. Именно за счет такой структуры металлы хорошо проводят электрический ток.
Подобное еще называют металлической связью. Ибо структура сама себя стабилизирует. За счет электронов протоны находятся на своих местах, а благодаря протонам электроны не способны покинуть пространство, ограниченно кристаллической решеткой.
![]()
В ее узлах находятся те частицы, которые являются положительно заряженными и в физике и химии, они носят название — ионы. Ну а окружают эти положительно заряженные частицы те, которые отрицательные и зовутся они в науке электронами.
![]()
А нектороые ученые(The Mirror of the Sacred Scriptures and Paintings World Foundation (Всемирный фонд «Зеркало священных текстов и картин»))
исследуя творчество Леонардо Да Винчи, предположили, что Бог выглядит так:


![]()
Частицы НЕ и НИ входят в состав отрицательных местоимений нечего и ничего, которые пишутся слитно.
Для правильного написания отрицательных местоимений необходимо просто обратить внимание или вспомнить правило, что частица не бывает только под ударением, а частица **ни* — только в местоимениях без ударения.
Рассмотрим предложения-примеры, которыми подтверждается сказанное.
Я услышала какой-то шорох, стала осматриваться, но в такой темноте ничегО не увидела.
Он ничегО никомУ не обещал, так что нЕчего от него что-то требовать.
Она понимала, что ничегО уже не исправить, но и сказать в свою защиту ей было нЕчего.
![]()
А. Н. Некрасов в своем творчестве воспевает русских женщин, крестьянок. В поэме «Мороз Красный нос» показана похороны главы крестьянской семьи, Прокола Севастьяновича. Его жена Дарья, главная героиня поэмы, хоронит мужа. Можно сказать, что главная героиня поэмы русская крестьянка.
На мой взгляд Прокл тоже главный герой поэмы, ведь Дарья не на минуту не забывает о муже, разговаривает с ним, рассказывает про свою жизнь, делится с ним своими мыслями:
Ну и конечно же главная роль отведена Морозу-воеводе. Он появляется во второй части поэмы. Он зовет Дарью в свое царство, всячески уговаривает ее. Прикинулся Проклом и Дарюшка сдалась:
В итоге Дарья замерзает и оставляет сиротами своих детей.
![]()
Начнем с инфинитива прийти как начальной форме слов «придешь», «пришла».
При — приставка ( у-й-ти, ото-й-ти);
-й — корень слова;
При/д/ешь — приставка/ корень/ окончание;
при/ ш/ л/ а — приставка/ корень/ суффикс/ окончание.
В глаголе обнять приставка уже не выделяется. Обня — корень, -ть — окончание.
В однокоренном слове объятие вычленим морфемы:
объя- корень слова, -ти- суффикс, -е — окончание.
Слово «изъять делим на морфемы вот так:
изъя — корень слова;
-ть — окончание глагола.
В слове взять выделим в качестве корня часть взя- (взя-ти-е, взя-т-ый);
![]()
Мудрые учителя справедливо считают, что читательский дневник — это творчество самого ребенка. И ведение такого дневника должно не превращаться в рутину и обязаловку, а приносить ребенку удовольствие. Поэтому форму читательского дневника разрешают придумывать самому ребенку. Но вначале учитель должен объяснить, что такое «читательский дневник» и с какой целью он ведется. Ученики четвертых классов уже взрослые детки и могут заинтересоваться этим процессом.
Для этого нужно купить ребенку ту тетрадь, которая ему понравилась. Пусть она будет с яркой красивой обложкой, например, с цветами и бабочками для девочки и с изображением машин — для мальчика.
А еще мне понравилась идея набрать страничку дневника на компьютере и распечатать на листах форматом А4. Одна страничка для одной книги. Для интереса можно взять разноцветную бумагу. Тогда у ребенка будет интерес дописать до листа определенного цвета, и он будет стараться читать быстро, вдумчиво и заполнять странички. Листы можно вкладывать в красивую папку с файлами или просто подшивать в скоросшиватель.
Учитель должен дать установку, что именно отражать в читательском дневнике, чтобы все дети придерживались одинакового объема. Вот такого, например, как на этом рисунке.

Остается еще дополнить эту страничку разделами «цитаты», «мой любимый эпизод», «о героях» и так далее и, конечно, оставить место для рисунка. Заставлять ребенка писать не следует, но хвалить за его творчество нужно непременно! Для стимула).
Виды кристаллических решеток металлов
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.



Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно озучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другиеположения, то мы имеем дело с твердым веществом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.
Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
Металлическаякристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.





Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Общее понятие о металлах
«Химия. 9 класс» — это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.

Смотреть галерею
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Свойства металлов
К специфическим свойствам рассматриваемых веществ относят следующие.
- Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
- Ковкость и пластичность — способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
- Электропроводность и теплопроводность — одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.

Смотреть галерею
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Научно-популярный журнал Познавайка
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Гранецентрированная решетка
Кристаллическое строение металлов, имеющих гранецентрированную кубическую решетку, представляет собой следующую структуру. Это куб, который включает в свой состав четырнадцать атомов. Восемь из них формируют узлы решетки, а еще шесть расположены по одному на каждой грани.
Подобную структуру имеют:
- алюминий;
- никель;
- свинец;
- гамма-железо;
- медь.
Основные отличительные свойства — блеск разного цвета, легкость, прочность, ковкость, повышенная устойчивость к коррозии.

Смотреть галерею
Презентация по химии на тему «Кристаллические решетки»

Описание презентации по отдельным слайдам:
Вещество – то, из чего состоит физическое тело.
Твердое вещество Аморфное нет определенной t пл., расположение частиц в них строго не упорядоченно смола стекло пластилин воск пластмассы Кристаллическое определенная t пл., правильное расположение частиц, из которых они построены: атомов, ионов, молекул хлорид натрия графит металлы
Кристаллические решётки веществ-это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки.
Вывод: Свойства веществ в твердом состоянии зависят от типа кристаллической решетки (прежде всего от того, какие частицы находятся в ее узлах).
Типы кристаллических решеток Ионные Атомные Молекулярные Металлические
Кристаллические решетки, вид связи и свойства веществ Тип решетки Виды частиц в узлах решетки Вид связи между частицами Примеры веществ Физические свойства веществ Ионная Молекулярная Атомная Металлическая
Ионные кристаллические решетки Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи. Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью.
Атомные кристаллические решетки Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз — самый твёрдый природный материал.
Металлические кристаллические решетки Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Молекулярные кристаллические решетки Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Вещества с МКР непрочные, имеют малую твёрдость, низкую температуру плавления, летучие, способны к возгонке. При обычных условиях находятся в газообразном или жидком состоянии .
Кристаллические решетки, вид связи и свойства веществ. Тип решетки Виды частиц в узлах решетки Вид связи между частицами Примеры веществ Физические свойства веществ Ионная Ионы Ионная связь — прочная Соли, оксиды и гидроксиды типичных металлов Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомная Атомы 1.Ковалентная не- полярная связь — очень прочная 2.Ковалентная полярная связь — очень прочная Простые вещества: алмаз(C), графит( C), бор(B), кремний( Si). Сложные вещества: оксид алюминия (Al2O3), оксид кремния (IV)-SiO2 Очень твердые, очень тугоплавкие, прочные, нелету-чие, нерастворимы в воде Молекуляр- ная Молекулы Между молекулами- слабые силы межмоле- лярного притяжения, а вот внутри молекул- прочная ковалентная связь Твердые вещества при особых условиях, при обычных газы или жидкости (О2, Н2, Cl2, N2, Br2, H2O, CO2, HCl); сера, белый фосфор, йод; органические вещества Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость Металли- ческая Атом-ионы Металлическая разной прочности Металлы и сплавы Ковкие, обладают блеском, пластичностью, тепло- и электропроводны
Вывод: Существует следующая закономерность: если известно строение веществ, то можно предсказать их свойства, и наоборот: если известны свойства веществ, то можно определить строение.

