Какие физические свойства характерны для металлов?
Физические свойства металлов

Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.

Рис. 1. Электрохимический ряд напряжений металлов.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
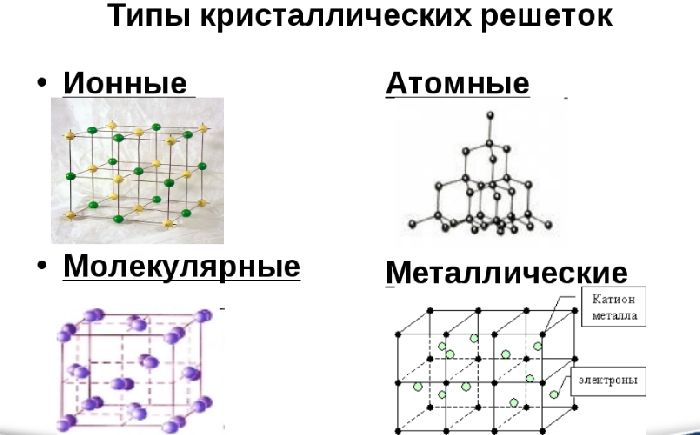
Рис. 2. Виды кристаллических решёток.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства
Особенности
Примеры
Применение
Способность отражать солнечный свет
Наиболее блестящими металлами являются Hg, Ag, Pd
Лёгкие – имеют плотность меньше 5 г/см 3
Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см 3
Изготовление облицовки, деталей самолётов
Тяжёлые – имеют плотность больше 5 г/см 3
Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см 3
Использование в сплавах
Способность изменять форму без разрушений (можно раскатать в тонкую фольгу)
Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn
Формовка, сгибание труб, изготовление проволоки
Мягкие – режутся ножом
Изготовление мыла, стекла, удобрений
Твёрдые – сравнимы по твёрдости с алмазом
Самый твёрдый – хром, режет стекло
Изготовление несущих конструкций
Легкоплавкие – температура плавления ниже 1000°С
Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C)
Производство радиотехники, жести
Тугоплавкие – температура плавления выше 1000°С
Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С)
Изготовление ламп накаливания
Способность передавать тепло другим телам
Лучше всего проводят ток и тепло Ag, Cu, Au, Al
Приготовление пищи в металлической посуде
Способность проводить электрический ток за счёт свободных электронов
Передача электричества по проводам
Рис. 3. Примеры применения металлов.
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Общая характеристика металлов
 Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.к увеличивается радиус атомов (за счет увеличения числа энергетических уровней). Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы IА-группы от Li до Fr. элементы ПА-группы от Мg до Rа). Общая электронная формула их атомов ns 1-2 . Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами — это ионные кристаллы «катион металлаанион неметалла», например К + Вг — , Сa 2+ О 2-. Катионы типичных металлов входят также в состав соединений со сложными анионами — гидроксидов и солей, например Мg 2+ (OН — )2, (Li + )2СO3 2-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аl-Gе-Sb-Ро, а также примыкающие к ним металлы (Gа, In, Тl, Sn, Рb, Вi) не проявляют типично металлических свойств. Общая электронная формула их атомов ns 2 np 0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры — соединения Тl III , Рb IV , Вi v ). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры — амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga2, в твердом состоянии хлориды алюминия и ртути (II) АlСl3 и НgСl2 содержат сильно ковалентные связи, но в растворе АlСl3 диссоциирует почти полностью, а НgСl2 — в очень малой степени (да и то на ионы НgСl + и Сl — ).
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
I. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 – t° → NiCl2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
II. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
III. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2) Металлы средней активности окисляются водой при нагревании до оксида:
3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:

В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+ )
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Общие способы получения металлов в промышленности:
• электрометаллургия, т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
• пирометаллургия, т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
• гидрометаллургия, т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений (металлические руды). По распространенности в земной коре металлы различны: от наиболее распространенных — Аl, Nа, Са, Fе, Мg, К, Тi) до самых редких — Вi, In, Аg, Аu, Рt, Rе.
Какие физические свойства характерны для металлов?





§ 61. Физические свойства металлов
Кристаллические решетку металлов сходны с атомными решетками. Но в атомных решетках связи между атомами ковалентные, а в металлах мы встречаемся с новым видом химической связи: металлической связью. Валентные электроны не закреплены в металлах каждый за своим атомом или своей парой атомов (как в ковалентных связях), а могут отщепляться от атомов и свободно блуждать между ними. Такие электроны осуществляют связь между ионами металла, наподобие прослойке воды между сложенными вместе пластинками: она позволяет перемещать пластинки относительно друг друга, но сопротивляется отрыванию одной пластинки от другой. Из такого внутреннего строения металлов проистекают их характерные, общие физические свойства:
- Пластичность. При деформации, т. е. изменении формы куска металла, происходит смещение пластов из ионов относительно друг друга, но разрыва не происходит, так как связывающие их электроны, соответственно переместившись, продолжают осуществлять связь между сместившимися ионами.
- Электропроводность. Она обусловливается свободой перемещения электронов, поскольку они не закреплены каждый за своим атомом, по всему куску металла.
- Высокая теплопроводность. Переносчиками тепловой энергии из одного участка в куске металла в другой являются главным образом те же электроны.
Они же являются причиной общих оптических свойств неметаллов — непрозрачности и металлического блеска.
По металлическому блеску мы узнаем металлы и их сплавы среди других веществ. Металлы блестят потому, что отражают от своей поверхности световые лучи, а не пропускают их, как стекло, и почти не поглощают, как сажа.
Металлы отражают не только видимый свет, но и невидимые радиоволны. Это свойство металлов используется в радиотелескопах, улавливающих радиоизлучения космоса, и в радиолокаторах, обнаруживающих самолеты на расстоянии сотен километров от наблюдателя.
Будучи общими всем металлам, перечисленные свойства проявляются у них в неодинаковой степени. Так, металлический блеск наиболее ярко проявляется у серебра; оно и применяется в производстве зеркал. Смотрясь в зеркало, мы видим свое отражение от тончайшего слоя серебра, нанесенного на заднюю поверхность стеклянной пластинки.
По электропроводности первое место среди всех веществ занимает то же серебро, к нему примыкают медь и алюминий. В электротехнике из-за дороговизны серебра в качестве материала для электропроводки используются медь и алюминий. Без этих металлов невозможно было бы передавать электрическую энергию на расстояния в десятки, сотни километров от вырабатывающей ее электростанции лишь с незначительными потерями в пути.
Электропроводность остальных металлов изменяется в очень широких пределах. Например, у вольфрама она в 340 раз меньше, чем у серебра. Техника нуждается и в таких металлах с умеренной электропроводностью. Они необходимы в электронагревательных устройствах. Нить накала электролампочки нагревается за счет сопротивления, оказываемого ею электрическому току, поэтому для изготовления ее нужен металлический материал с малой электропроводностью. Сейчас нити накала изготовляются главным образом из вольфрама.
Теплопроводность чистых металлов пропорциональна их электропроводности. Поэтому по теплопроводности металлы располагаются в такой же ряд как и по электропроводности: серебро, за ним следуют медь и алюминий, далее прочие металлы.
Основное механическое свойство металлов — пластичность — на практике проявляется в том, что под ударами молота металлы не дробятся на куски, а расплющиваются — они ковки. Первое место среди металлов по ковкости занимает золото. Его можно прокатывать в тончайшие полупрозрачные листы и вытягивать в тончайшую, невидимую глазом проволоку.
Из неспецифических для металлов физических свойств наибольший практический интерес имеют плотность, температура плавления и твердость.
Плотность металла тем меньше, чем меньше его атомный вес и чем больше радиус атома (почему?). Она у металлов изменяется в очень широких пределах — от 0,5 у лития до 22 у осмия. Металлы с плотностью ниже 5 называются легкими металлами. Из конструкционных металлов к легким относятся магний, алюминий и титан; они используются, главным образом, в строительстве транспорта, титан — в самолетах, летающих со сверхзвуковыми скоростями. Трение о воздух при таких скоростях вызывает сильное разогревание обшивки самолета, а прочность металлов при нагреве сильно снижается, прежде чем станет равной нулю, когда металл расплавится. У титана высокая температура плавления и снижения прочности у него в условиях скоростных полетов, в отличие от алюминиевых сплавов, не происходит.
В тех редких случаях, когда от металлического материала требуется возможно большая плотность (дробь, пули), используется свинец, хотя его плотность примерно вдвое меньше, чем у наиболее тяжелых, но дорогих металлов.
Свойства металлов: температура плавления, прочность, твердость — зависят главным образом от прочности металлической связи. Она у разных металлов неодинакова, и особенно велика у тяжелых металлов с достраивающимся предпоследним электронным слоем атома, поэтому такие металлы отличаются высокой тугоплавкостью и высокой твердостью.
Температуры плавления металлов изменяются в очень широких пределах: от -39°С у ртути до 3410°С у вольфрама. Ртуть как единственный жидкий при обычных условиях металл применяется в измерительных приборах, вольфрам — во всех случаях, когда требуется металлический материал, противостоящий особенно высоким температурам, например для нитей накала электролампочек.
В широких пределах изменяется и твердость металлов: щелочные металлы мягки, как воск, а самые твердые из металлов, к которым относятся вольфрам и хром, не поддаются обработке закаленными напильниками.
К числу общих свойств металлов относится их растворимость друг в друге. Такие растворы металлов называются сплавами. Для каждого металлического изделия и каждой металлической детали подбирается или создается «по заказу» такой материал, который наилучшим образом удовлетворяет назначению изделия или детали. Среди чистых металлов такого материала, в котором сочетались бы все заданные свойства, обычно не находится, и тогда мы обращаемся к сплавам.
Так, в электролампочке, кроме вольфрама и цинка — из него изготовлен цоколь,- мы находим два сплава. Припой — легкоплавкий сплав свинца с сурьмой и оловом, из него состоит контакт лампочки и спай патрона с проволочкой, подводящей ток к нити накала, сама же эта проволочка из платинита — сплава железа с никелем, расширяющегося при нагревании одинаково со стеклом, вследствие чего она может впаиваться в стекло и при нагревании в месте спая не трескается (рис. 49).
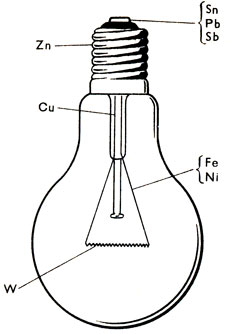
Рис. 49. В состав электролампочки входит семь металлов
Автомобильный справочник
для настоящих любителей техники
Свойства металлов

Металлы, это группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. В данной статье все свойства металлов будут представлены в виде отдельных таблиц.

Свойства металлов
Свойства металлов делятся на физические, химические, механические и технологические.
Физические свойства металлов
К физическим свойствам относятся: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании.
Удельный вес металла — это отношение веса однородного тела из металла к объему металла, т.е. это плотность в кг/м 3 или г/см 3 .
Плавкость металла — это способность металла расплавляться при определенной температуре, называемой температурой плавления.
Электропроводность металлов — это способность металлов проводить электрический ток, это свойство тела или среды, определяющее возникновение в них электрического тока под воздействием электрического поля. Под электропроводностью подразумевается способность проводить прежде всего постоянный ток (под воздействием постоянного поля), в отличие от способности диэлектриков откликаться на переменное электрическое поле колебаниями связанных зарядов (переменной поляризацией), создающими переменный ток.
Магнитные свойства металлов характеризуются: остаточной индукцией, коэрцетивной силой и магнитной проницаемостью.
Теплопроводность металлов — это их способность передавать тепло от более нагретых частиц к менее нагретым. Теплопроводность металла определяется количеством теплоты, которое проходит по металлическому стержню сечением в 1см 2 , длиной 1см в течение 1сек. при разности температур в 1°С.
Теплоемкость металлов — это количество теплоты, поглощаемой телом при нагревании на 1 градус. Отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества — мольной (молярной).
Расширяемость металлов при нагревании.Все металлы при нагревании расширяются, а при охлаждении сжимаются. Степень увеличения или уменьшения первоначального размера металла при изменении температуры на один градус характеризуется коэффициентом линейного расширения.
Химические свойства металлов
К химическим — окисляемость, растворимость и коррозионная стойкость.
Механические свойства металлов
К механическим — прочность, твердость, упругость, вязкость, пластичность.
Прочностью металла называется его способность сопротивляться действию внешних сил, не разрушаясь.
Твердостью металлов называется способность тела противостоять проникновению в него другого, более твердого тела.
Упругость металлов — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших изменение формы (деформацию).
Вязкость металлов — это способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам. Вязкость — свойство обратное хрупкости.
Пластичность металлов — это свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил. Пластичность—свойство обратное упругости.
Технологические свойства металлов
К технологическим — прокаливаемость, жидкотекучесть, ковкость, свариваемость, обрабатываемость резанием.
Прокаливаемость металлов – это их способность получать закаленный слой определенной глубины.
Жидкотекучесть металлов — это свойство металла в жидком состоянии заполнять литейную форму и воспроизводить ее очертания в отливке.
Ковкость металлов —это технологическое свойство, характеризующее их способность к обработке деформированием, например, ковкой, вальцеванием, штамповкой без разрушения.
Свариваемость металлов — это их свойство образовывать в процессе сварки неразъемное соединение, отвечающее требованиям, обусловленным конструкцией и эксплуатацией производимого изделия.
Обрабатываемость металлов резанием — это их способность изменять геометрическую форму, размеры, качество поверхности за счет механического срезания материала заготовки режущим инструментом. Обрабатываемость металлов зависит от их механических свойств, в первую очередь прочности и твердости.
Современными методами испытания металлов являются механические испытания, химический анализ, спектральный анализ, металлографический и рентгенографический анализы, технологические пробы, дефектоскопия. Эти испытания дают возможность получить представление о природе металлов, их строении, составе и свойствах, а также определить качество готовых изделий.
Таблицы свойств металлов
Таблица «Свойства металлов: Чугун, Литая сталь, Сталь»
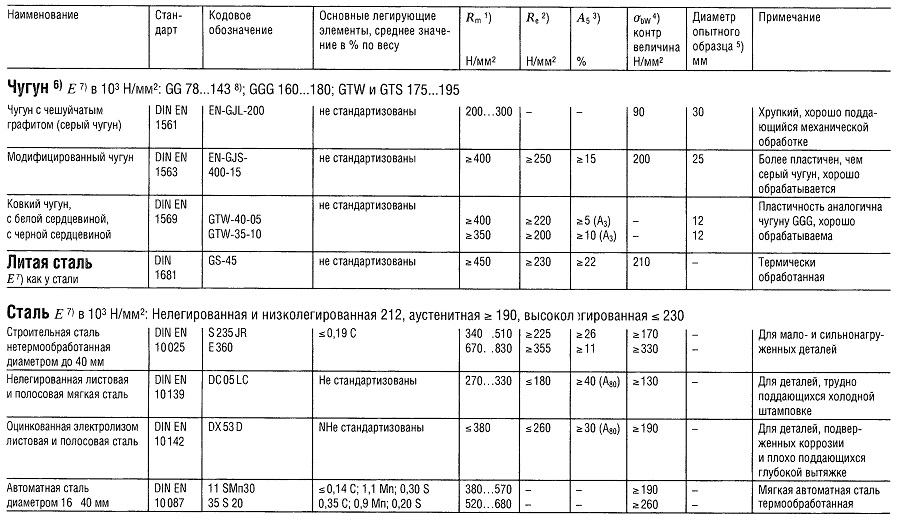
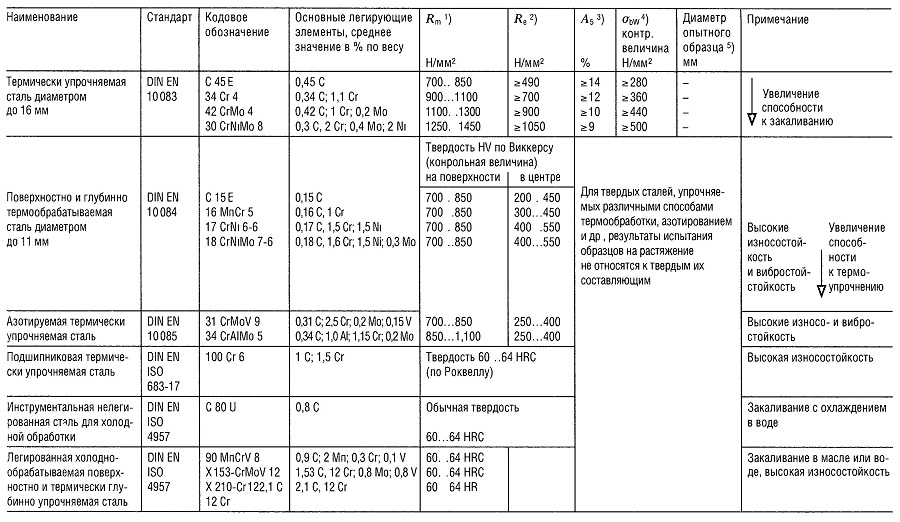
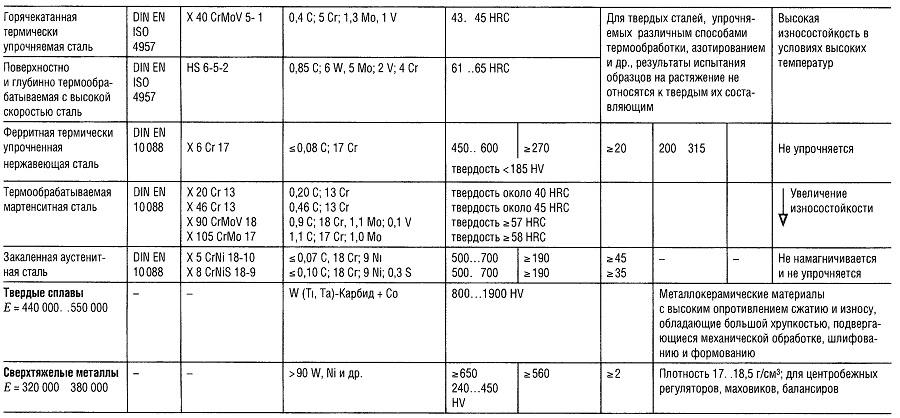
- Предел прочности на растяжение
- Предел текучести (или Rp 0,2);
- Относительное удлинение образца при разрыве;
- Предел прочности на изгиб;
- Предел прочности на изгиб приведен для образца из литой стали;
- Предел усталости всех типов чугуна, зависит массы и сечения образца;
- Модуль упругости;
- Для серого чугуна модуль упругости уменьшается с увеличением напряжения растяжения и остается практически постоянным с увеличением напряжения сжатия.
Таблица «Свойства пружинной стали»
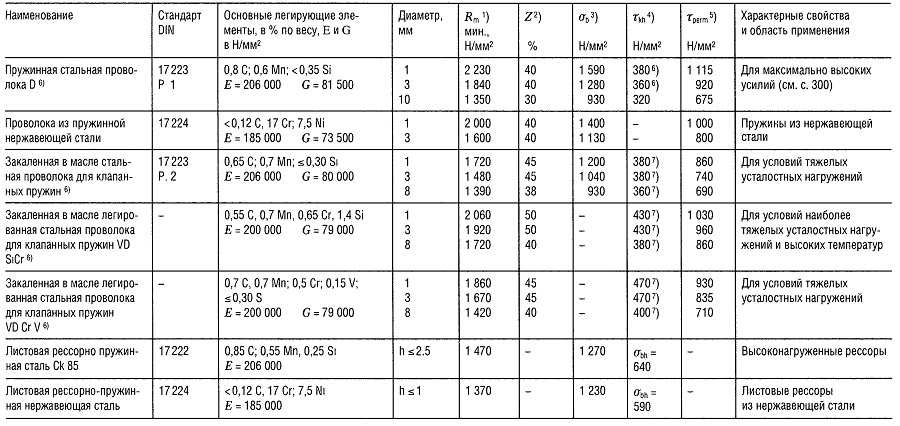
- Предел прочности на растяжение,
- Относительное уменьшение поперечного сечения образца при разрыве,
- Предел прочности на изгиб;
- Предел прочности при знакопеременном циклическом нагружении при N ⩾ 10 7 ,
- Максимальное напряжение при температуре 30°С и относительном удлинении 1 2% в течение 10 ч; для более высоких температур см. раздел «Способы соединения деталей»;
- 480 Н/мм 2 для нагартованных пружин;
- Приблизительно на 40% больше для нагартованных пружин
Таблица «Свойства кузовных тонколистовых металлов»
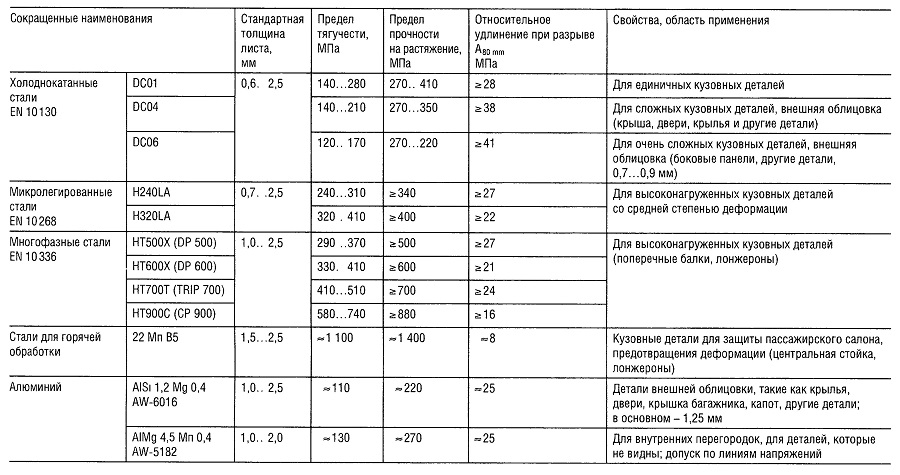
Таблица «Свойства цветных металлов»
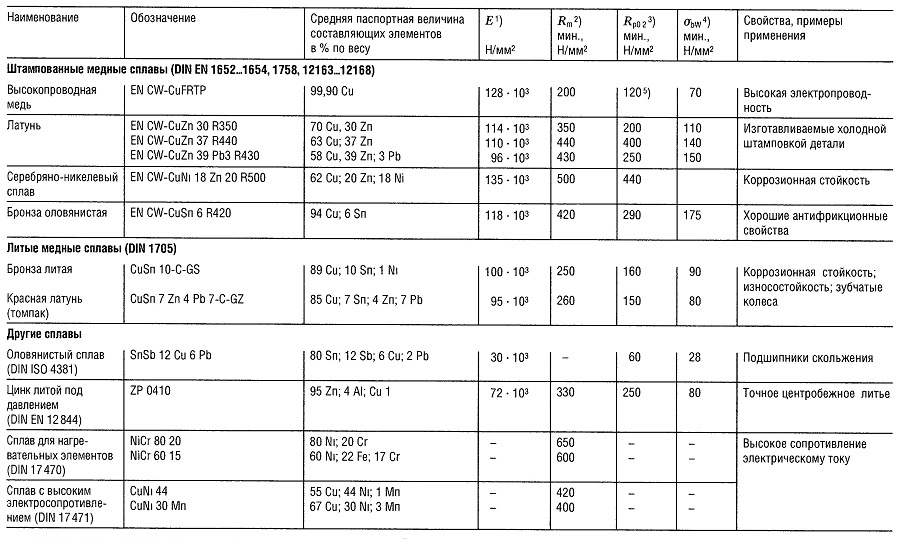
- Модуль упругости, справочные данные;
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Для отдельных образцов
Таблица «Свойства легких сплавов»
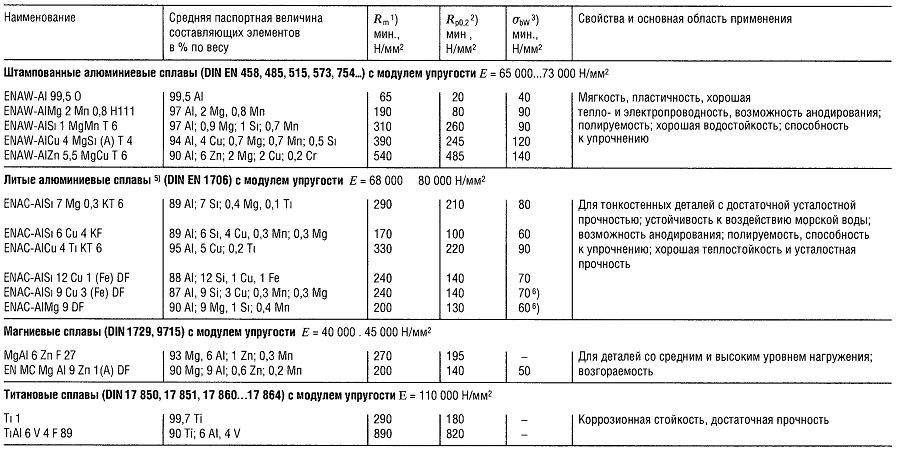
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Показатели прочности приведены для образцов и для отливок;
- Показатели предела прочности на изгиб приведены для случая плоского нагружения
Таблица «Металлокерамические материалы (PM) 1) для подшипников скольжения»
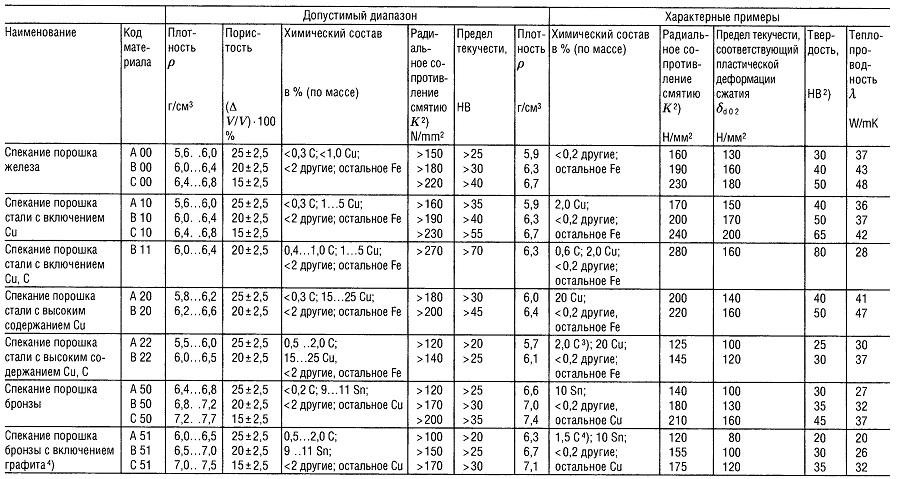
- В соответствии со стандартом DIN 30 910,1990 г. издания;
- Применительно к подшипнику 10/16 г 10;
- Углерод содержится, главным образом, в виде свободного графита;
- Углерод содержится только в виде свободного графита
Таблица «Свойства металлокерамических материалов (РМ) 1 для конструкционных деталей»
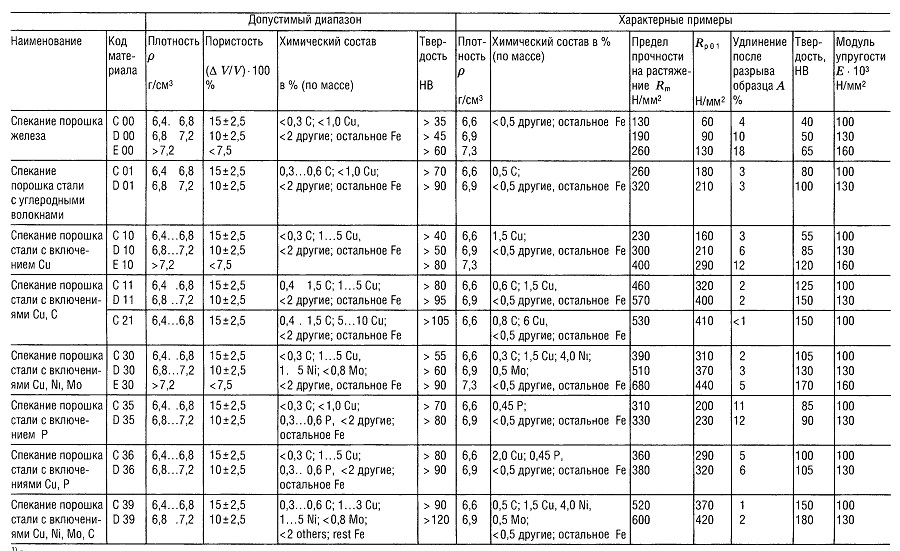
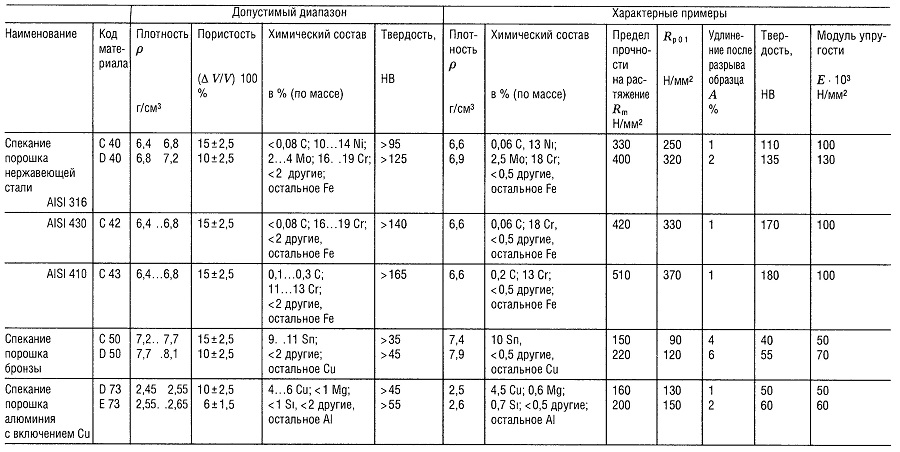
- В соответствии со стандартом DIN 30 910,1990 г. издания;
Магнитные материалы
Таблица «Свойства магнитомягких материалов»
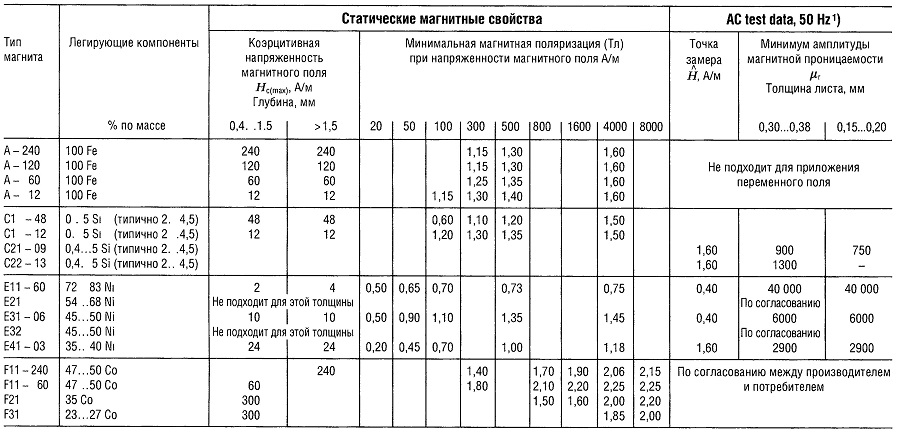
- Данные относятся только к магнитным кольцам.
Магнитомягкие металлы
Таблица «Свойства магнитной листовой и полосовой стали»
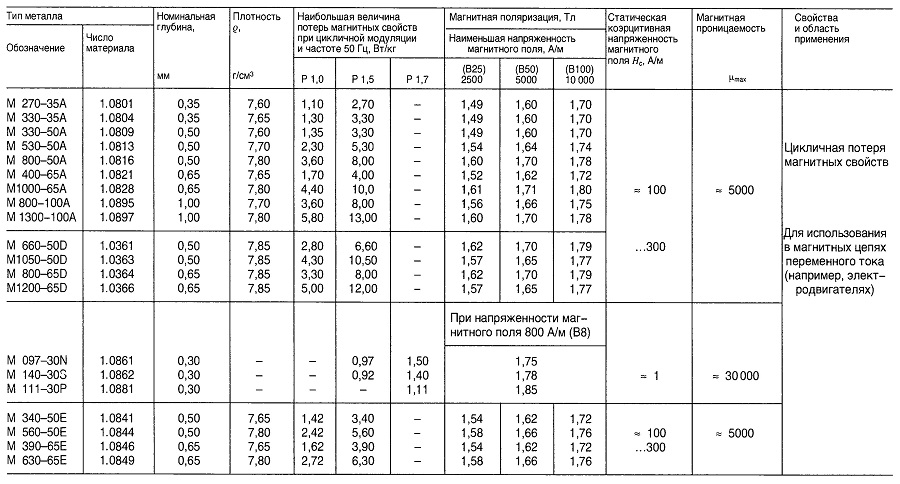
Материалы для преобразователей и электрических реакторов
Магнитная проницаемость листового сердечника для классов сплавов С21, С22, Е11, Е31 и Е41 для секции тонколистового сердечника EY11
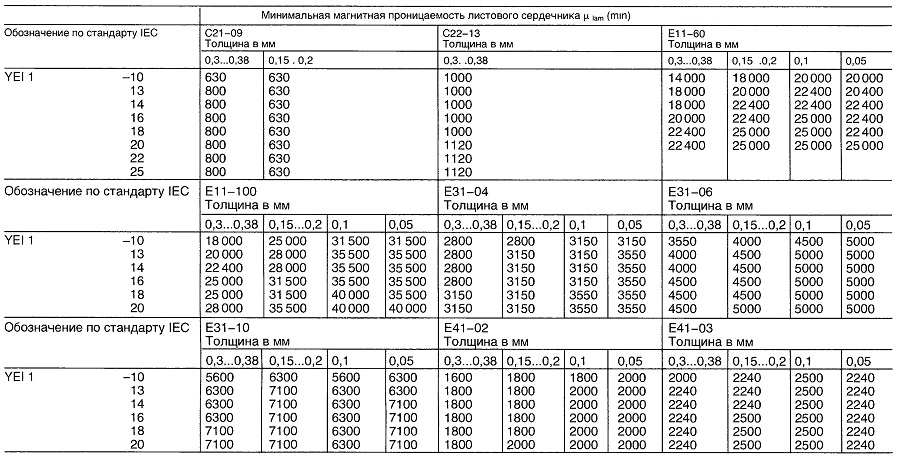
Материалы для реле постоянного тока
Таблица «Свойства материалов для реле постоянного тока»
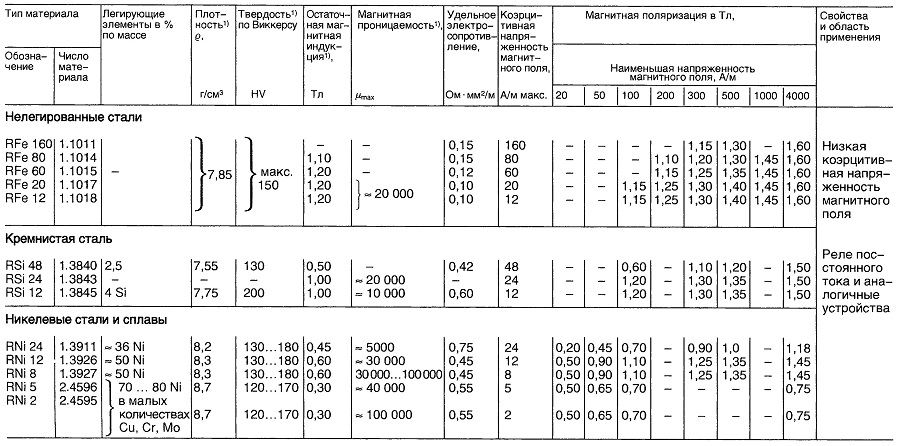
- Нормируемые величины
Металлокерамические материалы для магнитомягких компонентов
Таблица «Свойства металлокерамических материалов для магнитомягких компонентов»
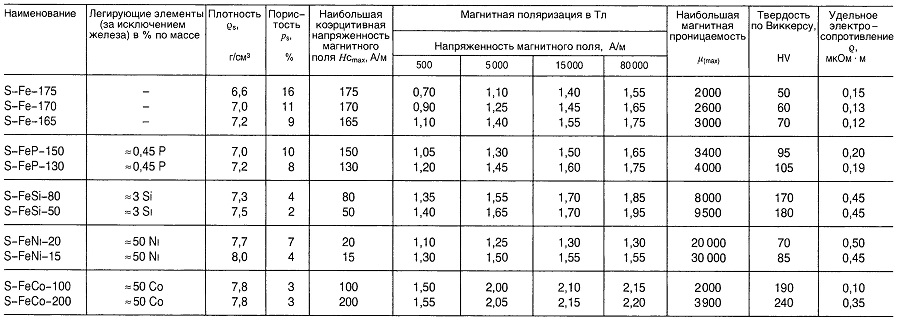
Магнитомягкие ферриты
Таблица «Свойства магнитомягких ферритов»

- Нормируемые величины;
- Потеря материалом магнитных свойств в зависимости от частоты при низкой плотности магнитного потока (В Эта статья размещена в главе Материалы для автомобилестроения и называется Свойства металлов. Добавьте в закладки ссылку.
Добавить комментарий Отменить ответ
Главы
- Энциклопедия техники (19)
- История автомобиля (20)
- Полезные советы (3)
- Действующие единицы (1)
- Законы физики в автомобиле (15)
- Математическое моделирование в автомобилестроении (3)
- Материалы для автомобилестроения (10)
- Рабочие жидкости (5)
- Детали машин (6)
- Способы соединения деталей (8)
- Физика автомобиля (10)
- Двигатели внутреннего сгорания (24)
- Диагностика двигателя (8)
- Нормы контроля и диагностики токсичности отработавших газов (17)
- Системы управления бензиновыми двигателями (11)
- Работа двигателя на альтернативных видах топлива (2)
- Системы управления дизельными двигателями (9)
- Альтернативные виды приводов (3)
- Трансмиссия (47)
- Системы шасси (18)
- Управление шасси и активная безопасность (6)
- Кузова автомобилей (10)
- Пассивная безопасность (1)
- Системы охраны автомобилей (1)
- Охранные автомобильные системы (1)
- Электрооборудование автомобилей (11)
- Свечи зажигания автомобилей (6)
- Автомобильная электроника (21)
- Системы комфорта и удобства (2)
- Пользовательские интерфейсы (3)
- Системы повышения безопасности дорожного движения (7)
О справочнике
За последние время автомобилестроение превратилось в чрезвычайно сложную отрасль. Все труднее и труднее становится представить всю отрасль в целом, и еще сложнее постоянно следить за направлениями, которые важны для автомобилестроения. Многие из этих направлений подробно описаны в специальной литературе. Тем не менее, для тех, кто впервые сталкивается с данными темами, имеющаяся специальная литература не представляется легкой и тяжело усваивается в ограниченные сроки. В этой связи этот «Автомобильный справочник» будет очень кстати. Он структурирован таким образом, чтобы быть понятным даже для тех читателей, которые впервые встречаются с каким-либо разделом. Наиболее важные темы, относящиеся к автомобилестроению, собраны в компактном, простом для понимания и удобном с практической точки зрения виде.
Какие физические свойства характерны для металлов?
Письмо с инструкцией по восстановлению пароля
будет отправлено на вашу почту
- Главная
- 9-Класс
- Химия
- Видеоурок «Физические свойства металлов»
- § 1 Свойства металлов
- § 2 Общие физические свойства металлов
- § 3 Отличительные особенности металлов
- § 4 Краткие итоги по теме урока
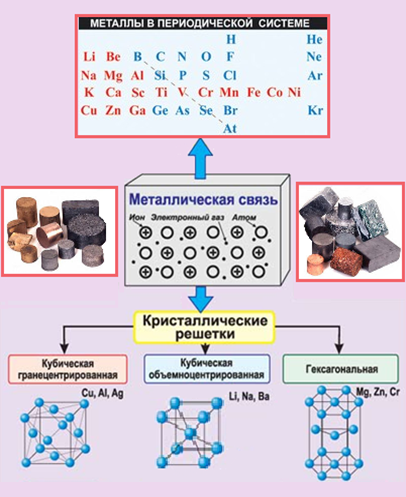
Физические свойства металлов объясняются особенностями строения их кристаллических решеток. В узлах решеток располагаются или положительно заряженные ионы металлов, или их атомы, а между ними перемещаются свободные электроны. Связь, между свободными электронами и ионами металла в кристаллической решетке, называется металлической.
Для металлов характерны как общие физические свойства, так и индивидуальные свойства. Металлический блеск, пластичность и ковкость, теплопроводность и электропроводность – это свойства, характерные для всех металлов, по ним отличают их от неметаллов. Температура плавления, плотность, твердость для каждого металла свои, в этом они отличаются друг от друга.
Пластичность– способность металла изменять форму под действием внешних сил без разрушения и сохранять ее после прекращения воздействия. При воздействии на металлическую кристаллическую решетку происходит смещение слоев атом-ионов металла относительно друг друга без разрыва связей, поэтому для них характерна высокая пластичность.
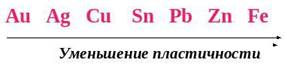
Наиболее пластичные металлы: золото, серебро, медь, олово, свинец. Например из 1 г золота можно получить тончайшую проволоку длиной около 3 км или же лист, способный покрыть потолок трехкомнатной квартиры площадью около 50 м2. Тончайшие листы золота, толщиной от 1 мкм до 3 мкм, называют сусальным золотом. Его применяют для декоративной отделки изделий, изготовленных в основном из дерева. Листочками сусального золота оклеивают резные деревянные рельефы, предназначенные для украшения интерьеров дворцов, храмов, дорогой мебели.
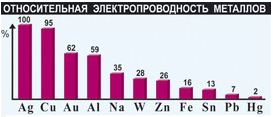
Электропроводность – свойство вещества проводить электрический ток.
В металлической кристаллической решетке присутствуют свободные электроны, которые при обычных условиях двигаются в беспорядке, а при попадании в электрическое поле начинают двигаться направлено, в результате чего возникает электрический ток.
Наибольшей электропроводностью обладают серебро, медь, золото, алюминий, железо;
а наименьшей – свинец, марганец, вольфрам и ртуть. При повышении температуры электропроводность металлов уменьшается, это объясняется усилением колебательного движения атомов-ионов металлов, что затрудняет направленное движение электронов. При понижении температуры электропроводность увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Медь и алюминий наиболее доступные металлы, поэтому их используют в виде проводников электрического тока.
Теплопроводность – способность металла передавать теплоту от более нагретых его частей менее нагретым. Это свойство металлов также объясняется подвижностью свободных электронов, они при движении сталкиваются с колеблющимися в узлах решетки ионами и обмениваются с ними энергией.
При повышении температуры колебания одних ионов передаются другим ионам с помощью электронов, и температура всего металлического предмета быстро выравнивается. Теплопроводность металлов изменяется в той же последовательности, что и электропроводность.
Наибольшей теплопроводностью обладают серебро, медь, золото, алюминий, железо; а наименьшей – свинец, марганец, вольфрам и ртуть.
Если одновременно в горячую воду опустить например чайные ложки, изготовленные из серебра, меди, золота, алюминия, железа, то быстрее нагреется ложка из серебра, так как ее теплопроводность выше теплопроводности других металлов, затем медная, золотая, алюминиевая и затем железная ложки.
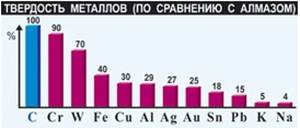
Твердость – способность твердого тела сопротивляться проникновению в него другого более твердого тела. Все металлы, за исключением ртути, при обычных условиях являются твердыми веществами.
По твердости металлы сравнивают с алмазом, твердость которого принята за 10.
Самыми мягкими являются щелочные металлы (цезий, рубидий, калий, натрий) их можно резать ножом, а самым твердым является хром, он царапают стекло.
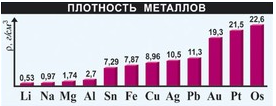
Плотность – величина, определяемая отношением массы тела к его объему.
По плотности металлы делятся на легкие (с плотностью менее 5 г/см3) и тяжелые (с плотностью более 5 г/см3). К легким металлам относятся щелочные (литий, натрий), щелочноземельные (кальций, магний) и алюминий. К тяжелым – цинк, железо, никель, медь, серебро, свинец, ртуть, золото, платина. Самый легкий металл – литий (0,53 г/см3), а самый тяжелый – осмий (22,6 г/см3).
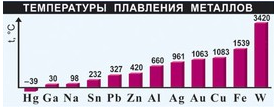
Плавкость металлов – это процесс перехода вещества из твердого в жидкое состояние. По температуре плавления металлы можно разделить на легкоплавкие и тугоплавкие.
К легкоплавким относятся металлы, температура плавления которых ниже 10000 С. Это ртуть, галлий, цезий, калий, олово, свинец, цинк, магний, алюминий.
Если температура плавления выше температуры плавления железа 15390 С, то металл является тугоплавким. К ним относятся: титан, хром, ванадий, цирконий, гафний, ниобий, молибден, вольфрам.
Самая низкая температура плавления у ртути – 390 С, поэтому это единственный металл, который при комнатной температуре находится в расплавленном состоянии. Самая высокая температура плавления у вольфрама 34200 С, из этого металла изготавливают нити накаливания электрических ламп.
К физическим свойствам металлов относятся: металлический блеск, пластичность и ковкость, теплопроводность и электропроводность, твердость, плотность, плавкость. Свойства металлов зависят от особенностей строения их кристаллических решеток. Все металлы обладают металлическим блеском, электропроводностью, теплопроводностью, пластичностью. Твердость, плотность и температура плавления и кипения металлов отличаются, на эти показатели влияют расположение атомов и ионов в узлах кристаллической решетки и их атомные радиусы.
Физические свойства металлов: твердость, плотность и др.
Физические свойства металлов.










Металлы имею такие физические свойства, как твердость, температуру плавления, плотность, пластичность, электропроводность, теплопроводность и цвет.
Твёрдость:
Все металлы, кроме ртути и, условно, франция, при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.
Таблица твёрдости металлов по шкале Мооса:
| Твёрдость | Металл |
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Температура плавления:
Температуры плавления чистых металлов лежат в диапазоне от −38,83 °C (ртуть) до 3422 °C (вольфрам).
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
В зависимости от температуры плавления металлы делятся на: легкоплавкие (до 600 °C); среднеплавкие (от 600 до 1600 °C); тугоплавкие (выше 1600 °C).
Таблица температуры плавления легкоплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Ртуть | -38,83 |
| Франций | 25 |
| Цезий | 28,44 |
| Галлий | 29,7646 |
| Рубидий | 39,3 |
| Калий | 63,5 |
| Натрий | 97,81 |
| Индий | 156,5985 |
| Литий | 180,54 |
| Олово | 231,93 |
| Полоний | 254 |
| Висмут | 271,3 |
| Таллий | 304 |
| Кадмий | 321,07 |
| Свинец | 327,46 |
| Цинк | 419,53 |
Таблица температуры плавления среднеплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Сурьма | 630,63 |
| Нептуний | 639 |
| Плутоний | 639,4 |
| Магний | 650 |
| Алюминий | 660,32 |
| Радий | 700 |
| Барий | 727 |
| Стронций | 777 |
| Церий | 795 |
| Иттербий | 824 |
| Европий | 826 |
| Кальций | 841,85 |
| Лантан | 920 |
| Празеодим | 935 |
| Германий | 938,25 |
| Серебро | 961,78 |
| Неодим | 1024 |
| Прометий | 1042 |
| Актиний | 1050 |
| Золото | 1064,18 |
| Самарий | 1072 |
| Медь | 1084,62 |
| Уран | 1132,2 |
| Марганец | 1246 |
| Бериллий | 1287 |
| Гадолиний | 1312 |
| Тербий | 1356 |
| Диспрозий | 1407 |
| Никель | 1455 |
| Гольмий | 1461 |
| Кобальт | 1495 |
| Иттрий | 1526 |
| Эрбий | 1529 |
| Железо | 1538 |
| Скандий | 1541 |
| Тулий | 1545 |
| Палладий | 1554,9 |
| Протактиний | 1568 |
Таблица температуры плавления тугоплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Лютеций | 1652 |
| Титан | 1668 |
| Торий | 1750 |
| Платина | 1768,3 |
| Цирконий | 1855 |
| Хром | 1907 |
| Ванадий | 1910 |
| Родий | 1964 |
| Технеций | 2157 |
| Гафний | 2233 |
| Рутений | 2334 |
| Иридий | 2466 |
| Ниобий | 2477 |
| Молибден | 2623 |
| Тантал | 3017 |
| Осмий | 3033 |
| Рений | 3186 |
| Вольфрам | 3422 |
Плотность:
В зависимости от плотности металлы делят на лёгкие (плотность от 0,53 до 5 г/см³) и тяжёлые (от 5 до 22,6 г/см³).
Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца ), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность:
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними.
Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты металла . Так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность:
Все металлы хорошо проводят электрический ток, обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля.
Серебро, медь и алюминий имеют наибольшую электропроводность. По этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также и натрий. В экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность:
Теплопроводность металлов зависит от подвижности свободных электронов.
Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла. Широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет у большинства металлов примерно одинаковый — светло-серый, иногда с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Металлы подразделяются на цветные и черные.
Чёрные металлы – железо и сплавы на его основе (стали, ферросплавы, чугуны). К чёрным металлам также зачастую относят марганец и, иногда, – хром и ванадий.
Цветные металлы — это особый класс нержавеющих металлов и сплавов, в составе которых нет железа. Металлы называются цветными, потому что каждый из них имеет определенный окрас. К цветным металлам относятся медь, молибден, свинец, цинк, олово, никель, кадмий, кобальт, алюминий, титан, магний, висмут, вольфрам, ртуть, золото, платину, серебро, палладий, родий, рутений, осмий, иридий.
