Какое свойство нехарактерно для всех металлов?
Общая характеристика металлов
 Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.к увеличивается радиус атомов (за счет увеличения числа энергетических уровней). Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы IА-группы от Li до Fr. элементы ПА-группы от Мg до Rа). Общая электронная формула их атомов ns 1-2 . Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами — это ионные кристаллы «катион металлаанион неметалла», например К + Вг — , Сa 2+ О 2-. Катионы типичных металлов входят также в состав соединений со сложными анионами — гидроксидов и солей, например Мg 2+ (OН — )2, (Li + )2СO3 2-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аl-Gе-Sb-Ро, а также примыкающие к ним металлы (Gа, In, Тl, Sn, Рb, Вi) не проявляют типично металлических свойств. Общая электронная формула их атомов ns 2 np 0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры — соединения Тl III , Рb IV , Вi v ). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры — амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga2, в твердом состоянии хлориды алюминия и ртути (II) АlСl3 и НgСl2 содержат сильно ковалентные связи, но в растворе АlСl3 диссоциирует почти полностью, а НgСl2 — в очень малой степени (да и то на ионы НgСl + и Сl — ).
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
I. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 – t° → NiCl2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
II. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
III. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2) Металлы средней активности окисляются водой при нагревании до оксида:
3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:

В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+ )
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Общие способы получения металлов в промышленности:
• электрометаллургия, т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
• пирометаллургия, т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
• гидрометаллургия, т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений (металлические руды). По распространенности в земной коре металлы различны: от наиболее распространенных — Аl, Nа, Са, Fе, Мg, К, Тi) до самых редких — Вi, In, Аg, Аu, Рt, Rе.
Общая характеристика металлов IА–IIIА групп
Содержание:
Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Металлы характеризуют по их положению в Периодической системе химических элементов Д. И. Менделеева (ПСХЭ или ПС), строению атома. Простые вещества-металлы, их сплавы подразделяют на легкие и тяжелые, тугоплавкие и легкоплавкие, выделяют благородные, описывают отношение к электрическому току.
Общая характеристика металлов
Периодическая система — совокупность горизонтальных рядов и вертикальных столбцов. Последние включают в себя подгруппы А (главные) и В (побочные). Элементы подгрупп расположены друг под другом, они похожи по строению и свойствам. Типичные металлы относятся к первым трем А-группам.

Мысленно проведем диагональ в ПС: сверху от лития и бериллия вниз — к астату (Рисунок 1). Слева внизу окажутся элементы-металлы, справа вверху расположены неметаллы. Чем левее и ниже, тем сильнее металлические свойства. По направлению вверх и вправо усиливается неметаллический характер элементов. Вблизи воображаемой линии расположены металлоиды, сочетающие свойства двух классов элементов. Их соединения также обладают двойственным характером.
В атомах химических элементов первых трех А-групп расположены 1–3 электрона на внешнем (валентном) энергетическом уровне. До его заполнения не хватает 7–5 электронов. Таким частицам легче отдать валентные электроны, чем присоединить недостающие. При этом образуются ионы с зарядами от +1 до +3 (одно-трехзарядные катионы). Типичные валентности металлов — от I(+) до III(+), степени окисления — от + до 3 + . Металлы В-групп могут отдавать электроны предвнешнего уровня. Валентности, степени окисления и заряды ионов в этом случае возрастают.
Радиусы металлов сравнительно большие, что тоже объясняет слабую связь внешних электронов с ядром. Закономерное возрастание радиусов наблюдается в группах сверху вниз. Также в этом направлении усиливаются металлические (восстановительные) свойства. Слева направо в периодах металлические свойства ослабевают, а неметаллические — усиливаются.
Низкие значения относительной электроотрицательности, малое сродство к электрону — еще одна общая черта металлов. В целом, это сильные восстановители, для которых нехарактерны окислительные свойства. В химических реакциях атомы металлических элементов легко отдают внешние электроны окислителям, при этом приобретают электронное строение инертного газа из предыдущего периода.
Сходством электронного строения обусловлены физические свойства металлов. (Рис. 2).
Наличием свободных электронов в виде «электронного газа» обусловлена высокая электропроводность металлов. Они обычно имеют светло- или темно-серый цвет, обладают характерным блеском. Это ковкие, пластичные вещества, что используются при изготовлении проволоки, проката. Теплопроводность и электропроводность металлов имеют большое практическое значение.
Кристаллическая решетка металлов отличается от других типов наличием «электронного газа». Щелочные металлы — самые мягкие, они легко сгибаются, режутся ножом.. Хром царапает стекло, что характерно для твердых веществ, например, алмаза, корунда. Самый легкий металл — литий, тяжелый – осмий. Ртуть плавится при 30°С, вольфрам — почти при 3400°С.
Восстановительные свойства металлов представлены в их последовательности, получившей название «Электрохимический ряд напряжений ( ряд активности металлов )». (Рис. 3).
Слева направо в ЭХРН восстановительная активность металлы, а именно способность отдавать электрон, снижается.
Металлы реагируют с кислородом с получением оксидом. С водородом образуют гидриды (только металлы IА и IIА групп), с серой — сульфиды. Металлы вступают в химические реакции с галогенами и азотом.
Щелочные и щелочноземельные металлы реагируют с водой с образованием растворимых оснований. В реакции выделяется водород, который нередко вспыхивает из-за выделения тепла в результате взаимодействия веществ.
Металлы, расположенные в ЭХРН до водорода, вытесняют Н2 из растворов кислот. Металлы после водорода — менее активные. Медь, ртуть, золото, серебро и платина не взаимодействуют с кислотами с вытеснением Н2.
Более активные металлы могут вытеснять металлы, расположены в ЭХРН правее, из растворов солей. Это и другие свойства широко используются для получения металлов, их важнейших соединений.
Характеристика металлов IA группы
Элементы Li, Na, K, Rb, Cs, Fr обладают сильными металлическими свойствами. Свое тривиальное название «щелочные металлы» они получили за едкие свойства растворимых оснований (щелочей). Лучше изучены первые три представителя группы. Франций является радиоактивным элементом, его химические свойства еще только исследуются в экспериментах.
Общая характеристика по положению в ПС и строению атома:
- Заряды ядер соответствуют порядковым номерам элементов, только со знаком «+». Например, заряд ядра натрия равен + 11, калия + 19.
- Электронная конфигурация в невозбужденном состоянии повторяет строение предыдущего инертного газа плюс 1 электрон на уровне, имеющем такой же номер, как период. Например, строение атома лития отражает формула (He)2s 1 , где (He) — это электронное строение атома гелия 1s 2 , а 2s 1 — номер последнего энергетического уровня, подуровень, количество электронов на нем.
- Радиус элементов IA группы возрастает от 0,152 у лития до 0,248 нм у рубидия. Электроотрицательность снижается от лития (0,98) до франция (0,7).
- Внешний энергетический уровень содержит 1 электрон, слабо связанный с ядром. Отдавая его, атомы превращаются в однозарядные катионы.
Щелочные металлы образуют соединения с ионной кристаллической решеткой с галогенами, кислородом и азотом.
Простые вещества химически очень активны: взаимодействуют с водой со взрывом, загораются на воздухе. Щелочные металлы хранят в лабораториях в запаянных ампулах, или в банках под слоем жидкости, не содержащей воду.
Ионы существенно отличаются по свойствам от атомов. Натрий, калий в виде однозарядных катионов являются макроэлементами, необходимыми для живых организмов.
Характеристика металлов IIA группы
Элементы IIA группы — Ве, Mg, Са, Sr, Ва, Ra. Радий — радиоактивный элемент. Электронное строение атомов IА и IIА групп имеет много общего. Повторяется конфигурация энергетических уровней инертного газа из предыдущего периода, дополненная двумя s-электронами на последнем уровне. Например, электронная конфигурация Са (Ar)4s 2 .
Радиус атомов возрастает сверху вниз от 0,112 у бериллия до 215 нм у стронция. Электроотрицательность выше, чем у щелочных металлов. ЭО бериллия — 1,57, магния — 1,31, кальция — 1, стронция — 0,95. Щелочноземельные металлы проявляют валентность II(+), степень окисления +2. Образуют двухзарядные катионы, например, Са 2+ .
Все щелочноземельные металлы при комнатной температуре — твердые вещества. Цвет серый или темно-серый, блеск металлический. Стронций режется ножом, кальций с трудом, магний твердый.
Общие признаки:
- относятся к s-элементам;
- на внешнем электронном слое по 1 и по 2 электрона;
- в свободном состоянии в периоде не встречаются;
- все металлы серебристо-белого цвета;
- имеют низкие температуры кипения и плавления
Внутри групп существуют различия в химических свойствах. Например, бериллий и магний больше напоминают алюминий, отличаются от кальция и бария. Щелочноземельные металлы в химических реакциях с окислителями легко отдают валентные электроны и превращаются в двухзарядные катионы. Химическая активность повышается от бериллия к радию.
Характеристика металлов IIIA группы
Представители —В, Al, Ga, In, Tl. Бор в этой подгруппе — единственный неметалл. Заряд ядер атомов возрастает от 5 у бора до 81 у таллия. Атомный радиус в том же порядке увеличивается с 0,091 до 0,171 нм. Электроотрицательность снижается с 2,04 до 1,44.
Для электронной конфигурации металлов IIIA группы характерно наличие двух спаренных s-электронов и одного р-электрона. В «реальном» атоме все электроны внешнего энергетического уровня выравниваются по форме и энергии в результате sp2-гибридизации. Характерные валентность, степень окисления и заряд ионов в этой группе — III(+), +3, 3 + соответственно. Изменения свойств представлены в схеме 1.
Простые вещества имеют металлический блеск, серебристо-белый цвет. Они относительно легкоплавкие и мягкие. Лист или проволока из алюминия легко сгибаются, а индий — один из самых мягких металлов. Талий не только мягкий, но и твердеет при низкой температуре около –60°С.
Эка-таллий или нихоний — относительно недавно открытый, еще недостаточно изученный элемент IIIA группы.
Свойства галлия и индия близки к химии алюминия. Причина — одинаковое строение внешнего энергетического уровня. Алюминий имеет высокие тепло- и электропроводность.
Общие свойства металлов IА–IIIА групп ПС обусловлены сходством в электронном строении внешних электронных оболочек. Радиусы атомов и свойства закономерно изменяются. Более сильные металлические элементы — последние представители в группах. Самые сильные металлы относятся к IА группе. К IIIА группе металлические свойства ослабевают.
Свойства простых веществ — металлов и неметаллов
Теория к заданию 6 из ЕГЭ по химии
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^<2>2s^<2>2p^<6>3s^<1>3p^<0>3d^<0>$, где $3s, 3p, 3d$ — валентные орбитали.
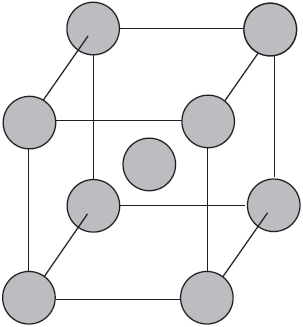
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
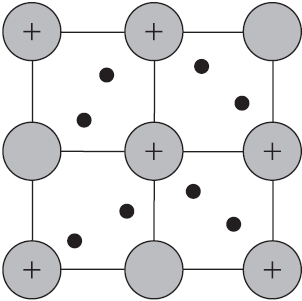
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_ <пл.>железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
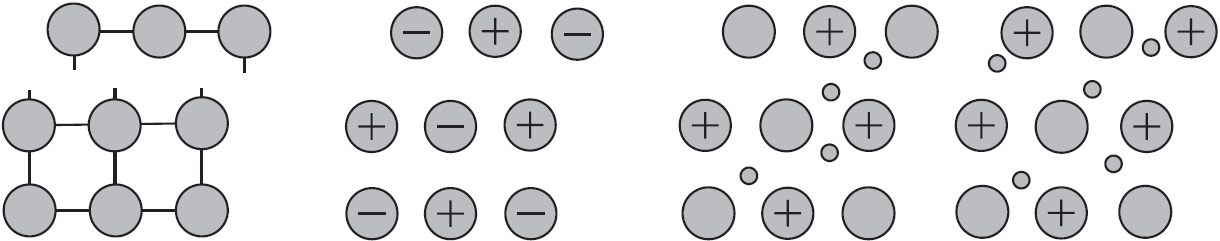
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_<пл.>=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
§ 9. Физические свойства металлов
Из курса химии 9 класса вы уже имеете представление о природе химической связи, существующей в кристаллах металлов, — металлической связи. Напомним, что в узлах металлических кристаллических решёток располагаются атомы и положительные ионы металлов, связанные посредством обобществлённых внешних электронов, принадлежащих всему кристаллу. Эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решётки.
Металлическая связь обусловливает все важнейшие физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск и другие свойства, характерные для этого класса простых веществ.
Пластичность — это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. Оно лежит в основе такой уважаемой большинством народов мира профессии, как профессия кузнеца. Недаром покровителем кузнечного дела у разных народов был бог огня: у греков — Гефест, у римлян — Вулкан, у славян — Сварог.
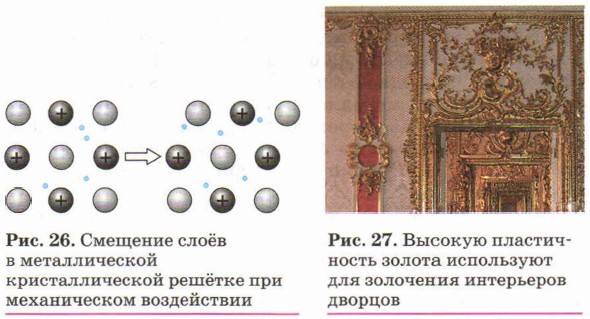
Пластичность металлов обусловлена способностью одних слоёв атом-ионов в кристаллах под внешним воздействием легко смещаться (как бы скользить) по отношению к другим слоям без разрыва связей между ними (рис. 26). Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий (рис. 27).
Высокая электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля (рис. 28).
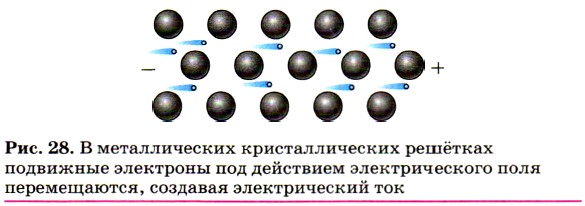
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. При охлаждении электропроводность металлов увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, наименьшую — марганец, свинец, ртуть и вольфрам.
Такое свойство, как теплопроводность металлов, также связано с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решётки ионами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов при посредстве электронов передаются другим ионам, и температура всего металлического предмета быстро выравнивается.
Для гладкой поверхности металлов характерен металлический блеск — результат отражения световых лучей. В порошкообразном состоянии большинство металлов теряет блеск, приобретая чёрную или серую окраску, и только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала, в том числе и применяемые в прожекторах.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет. Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для всех металлов (кроме ртути) при обычных условиях характерно твёрдое агрегатное состояние. Однако твёрдость их различна. Наиболее твёрдые — металлы побочной подгруппы VI группы (VIB группы) Периодической системы Д. И. Менделеева. Так, хром по твёрдости приближается к алмазу. Самые мягкие — металлы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева — щелочные металлы. Например, натрий и калий легко режутся ножом.

По плотности металлы делят на лёгкие (плотность меньше 5 г/см 3 ) и тяжёлые (плотность больше 5 г/см 3 ). К лёгким относят щелочные, щёлочноземельные металлы и алюминий. Из переходных металлов сюда включают скандий, иттрий и титан. Эти металлы, благодаря лёгкости и тугоплавкости, всё шире применяют в различных областях техники.
Самый лёгкий металл — это литий (р = 0,53 г/см 3 ). Самый тяжёлый — осмий (р = 22,6 г/см 3 ).
Лёгкие металлы обычно легкоплавки, галлий может плавиться уже на ладони руки, а тяжёлые металлы — тугоплавки. Наибольшей температурой плавления, которая равна 3380 °С, обладает вольфрам. Это свойство вольфрама используют для изготовления ламп накаливания (рис. 29, 2). Кроме него в конструкцию лампы входят ещё семь металлов.
В Российской Федерации в настоящее время, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например галогенные, люминесцентные и светодиодные. Галогенная лампа (рис. 29, 2) — это та же лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или иода).

Люминесцентные (рис. 29, 3) — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток — они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы (рис. 29, 4) — самые экономичные и самые долговечные (срок работы до 100 тыс. ч), но пока и самые дорогие из ламп.
В технике, как вы уже знаете, металлы делят на чёрные (железо и его сплавы) и цветные (все остальные, более подробно о них будет рассказано в следующем параграфе) (рис. 30). Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам (рис. 31). 1


1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.

1. Назовите самый легкоплавкий металл.
2. Какие физические свойства металлов используют в технике?
3. Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия. Почему? Где это свойство находит применение?
4. Какие физические свойства вольфрама лежат в основе его применения в лампах накаливания?
5. Какие свойства металлов лежат в основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи»?
- Физические свойства металлов. Ответы
Восстановительные свойства металлов
Восстановительные свойства — это главные химические свойства, характерные для всех металлов. Они проявляются во взаимодействии с самыми разнообразными окислителями, в том числе с окислителями из окружающей среды. В общем виде взаимодействие металла с окислителями можно выразить схемой:
Ме + Окислитель « Me(+Х),
где (+Х) – это положительная степень окисления Ме.
Примеры окисления металлов.
Zn + H + → Zn(+2) Zn + 2H + = Zn 2+ + H2
Ряд активности металлов
Восстановительные свойства металлов отличаются друг от друга. В качестве количественной характеристики восстановительных свойств металлов используют электродные потенциалы Е.
Чем активнее металл, тем отрицательнее его стандартный электродный потенциал Е о .
Металлы, расположенные в ряд по мере убывания окислительной активности, образуют ряд активности.
Ряд активности металлов
Восстановление металла из раствора его соли с другим металлом с более высокой восстановительной активностью называется цементацией. Цементацию используют в металлургических технологиях.
В частности, Cd получают, восстанавливая его из раствора его соли цинком.
Zn + Cd 2+ = Cd + Zn 2+
3.3. 1. Взаимодействие металлов с кислородом
Кислород – это сильный окислитель. Он может окислить подавляющее большинство металлов, кроме Au и Pt . Металлы, находящиеся на воздухе, контактируют с кислородом, поэтому при изучении химии металлов всегда обращают внимание на особенности взаимодействия металла с кислородом.
Всем известно, что железо во влажном воздухе покрывается ржавчиной — гидратировааным оксидом железа. Но многие металлы в компактном состоянии при не слишком высокой температуре проявляют устойчивость к окислению, так как образуют на своей поверхности тонкие защитные пленки. Эти пленки из продуктов окисления не позволяют окислителю контактировать с металлом. Явление образования на поверхности металла защитных слоев, препятствующих окислению металла, называется – пассивацией металла.
Повышение температуры способствует окислению металлов кислородом. Активность металлов повышается в мелкораздробленном состоянии. Большинство металлов в виде порошка сгорает в кислороде.
s-металлы
Наибольшую восстановительную активность проявляют s-металлы. Металлы Na, K, Rb Cs способны воспламеняться на воздухе, и их хранят в запаянных сосудах или под слоем керосина. Be и Mg при невысоких температурах на воздухе пассивируются. Но при поджигании лента из Mg сгорает с ослепительным пламенем.
Металлы IIА-подгруппы и Li при взаимодействии с кислородом образуют оксиды.
Щелочные металлы, кроме Li, при взаимодействии с кислородом образуют не оксиды, а пероксиды Me2O2 и надпероксиды MeO2.
р-металлы
Металлы, принадлежащие p-блоку на воздухе пассивируются.
При горении в кислороде
- металлы IIIА-подгруппы образуют оксиды типа Ме2О3,
- Sn окисляется до SnO2, а Pb — до PbO
- Bi переходит в Bi2O3.
d-металлы
Все d-металлы 4 периода окисляются кислородом. Легче всего окисляются Sc, Mn , Fe. Особенно устойчивы к коррозии Ti, V, Cr.
При сгорании в кислороде из всех d-элементов 4 периода только скандий, титан и ванадий образуют оксиды, в которых Ме находится в высшей степени окисления, равной № группы. Остальные d-металлы 4 периода при сгорании в кислороде образуют оксиды, в которых Ме находится в промежуточных, но устойчивых степенях окисления.
При сгорании в кислороде из всех d-элементов 4 периода только скандий, титан и ванадий образуют оксиды, в которых Ме находится в высшей степени окисления, равной № группы. Остальные d-металлы 4 периода при сгорании в кислороде образуют оксиды, в которых Ме находится в промежуточных, но устойчивых степенях окисления.
Типы оксидов, образуемых d-металлами 4 периода при горении в кислороде:
- МеО образуют Zn, Cu, Ni, Co. (при Т>1000оС Cu образует Cu2O),
- Ме2О3, образуют Cr, Fe и Sc,
- МеО2— Mn, и Ti,
- V образует высший оксид — V2O5.
d-металлы 5 и 6 периодов, кроме Y, La, более всех других металлов устойчивы к окислению. Не реагируют с кислородом Au, Pt.
При сгорании в кислороде d-металлов 5и 6 периодов, как правило, образуют высшие оксиды, исключение составляют металлы Ag, Pd, Rh, Ru.
Типы оксидов, образуемых d-металлами 5и 6 периодов при горении в кислороде:
- Ме2О3 – образуют Y, La; Rh;
- МеО2 – Zr, Hf; Ir:
- Me2O5 – Nb, Ta;
- MeO3 – Mo, W
- Me2O7 – Tc, Re
- МеО4 – Os
- MeO – Cd, Hg, Pd;
- Me2O – Ag;
Взаимодействие металлов с кислотами
В растворах кислот катион водорода является окислителем. Катионом Н + могут быть окислены металлы, стоящие в ряду активности до водорода, т.е. имеющие отрицательные электродные потенциалы.
Многие металлы, окисляясь, в кислых водных растворах многие переходят в катионы Me z + .
Анионы ряда кислот способны проявлять окислительные свойства, более сильные, чем Н + . К таким окислителям относятся анионы и самых распространенных кислот H2SO4 и HNO3.
Анионы NO3– проявляют окислительные свойства при любой их концентрации в растворе, но продукты восстановления зависят от концентрации кислоты и природы окисляемого металла.
Анионы SO4 2– проявляют окислительные свойства лишь в концентрированной H2SO4.
Продукты восстановления окислителей: H + , NO3 — , SO4 2 —
2Н + + 2е – = Н2
SO4 2– из концентрированной H2SO4 SO4 2– + 2e — + 4H + = SO2 + 2H2O
(возможно также образование S, H2S)
NO3 – из концентрированной HNO3 NO3 – + e — + 2H + = NO2 + H2O
NO3 – из разбавленной HNO3 NO3 – + 3e — + 4H + = NO + 2H2O
(возможно также образование N2O, N2, NH4 + )
Примеры реакций взаимодействия металлов с кислотами
Продукты окисления металлов в кислых растворах
Щелочные металлы образуют катион типа Ме + , s-металлы второй группы образуют катионы Ме 2+ .
Металлы р-блока при растворении в кислотах образуют катионы, указанные в таблице.
Металлы Pb и Bi растворяют только в азотной кислоте.
Какое свойство нехарактерно для всех металлов?





§ 61. Физические свойства металлов
Кристаллические решетку металлов сходны с атомными решетками. Но в атомных решетках связи между атомами ковалентные, а в металлах мы встречаемся с новым видом химической связи: металлической связью. Валентные электроны не закреплены в металлах каждый за своим атомом или своей парой атомов (как в ковалентных связях), а могут отщепляться от атомов и свободно блуждать между ними. Такие электроны осуществляют связь между ионами металла, наподобие прослойке воды между сложенными вместе пластинками: она позволяет перемещать пластинки относительно друг друга, но сопротивляется отрыванию одной пластинки от другой. Из такого внутреннего строения металлов проистекают их характерные, общие физические свойства:
- Пластичность. При деформации, т. е. изменении формы куска металла, происходит смещение пластов из ионов относительно друг друга, но разрыва не происходит, так как связывающие их электроны, соответственно переместившись, продолжают осуществлять связь между сместившимися ионами.
- Электропроводность. Она обусловливается свободой перемещения электронов, поскольку они не закреплены каждый за своим атомом, по всему куску металла.
- Высокая теплопроводность. Переносчиками тепловой энергии из одного участка в куске металла в другой являются главным образом те же электроны.
Они же являются причиной общих оптических свойств неметаллов — непрозрачности и металлического блеска.
По металлическому блеску мы узнаем металлы и их сплавы среди других веществ. Металлы блестят потому, что отражают от своей поверхности световые лучи, а не пропускают их, как стекло, и почти не поглощают, как сажа.
Металлы отражают не только видимый свет, но и невидимые радиоволны. Это свойство металлов используется в радиотелескопах, улавливающих радиоизлучения космоса, и в радиолокаторах, обнаруживающих самолеты на расстоянии сотен километров от наблюдателя.
Будучи общими всем металлам, перечисленные свойства проявляются у них в неодинаковой степени. Так, металлический блеск наиболее ярко проявляется у серебра; оно и применяется в производстве зеркал. Смотрясь в зеркало, мы видим свое отражение от тончайшего слоя серебра, нанесенного на заднюю поверхность стеклянной пластинки.
По электропроводности первое место среди всех веществ занимает то же серебро, к нему примыкают медь и алюминий. В электротехнике из-за дороговизны серебра в качестве материала для электропроводки используются медь и алюминий. Без этих металлов невозможно было бы передавать электрическую энергию на расстояния в десятки, сотни километров от вырабатывающей ее электростанции лишь с незначительными потерями в пути.
Электропроводность остальных металлов изменяется в очень широких пределах. Например, у вольфрама она в 340 раз меньше, чем у серебра. Техника нуждается и в таких металлах с умеренной электропроводностью. Они необходимы в электронагревательных устройствах. Нить накала электролампочки нагревается за счет сопротивления, оказываемого ею электрическому току, поэтому для изготовления ее нужен металлический материал с малой электропроводностью. Сейчас нити накала изготовляются главным образом из вольфрама.
Теплопроводность чистых металлов пропорциональна их электропроводности. Поэтому по теплопроводности металлы располагаются в такой же ряд как и по электропроводности: серебро, за ним следуют медь и алюминий, далее прочие металлы.
Основное механическое свойство металлов — пластичность — на практике проявляется в том, что под ударами молота металлы не дробятся на куски, а расплющиваются — они ковки. Первое место среди металлов по ковкости занимает золото. Его можно прокатывать в тончайшие полупрозрачные листы и вытягивать в тончайшую, невидимую глазом проволоку.
Из неспецифических для металлов физических свойств наибольший практический интерес имеют плотность, температура плавления и твердость.
Плотность металла тем меньше, чем меньше его атомный вес и чем больше радиус атома (почему?). Она у металлов изменяется в очень широких пределах — от 0,5 у лития до 22 у осмия. Металлы с плотностью ниже 5 называются легкими металлами. Из конструкционных металлов к легким относятся магний, алюминий и титан; они используются, главным образом, в строительстве транспорта, титан — в самолетах, летающих со сверхзвуковыми скоростями. Трение о воздух при таких скоростях вызывает сильное разогревание обшивки самолета, а прочность металлов при нагреве сильно снижается, прежде чем станет равной нулю, когда металл расплавится. У титана высокая температура плавления и снижения прочности у него в условиях скоростных полетов, в отличие от алюминиевых сплавов, не происходит.
В тех редких случаях, когда от металлического материала требуется возможно большая плотность (дробь, пули), используется свинец, хотя его плотность примерно вдвое меньше, чем у наиболее тяжелых, но дорогих металлов.
Свойства металлов: температура плавления, прочность, твердость — зависят главным образом от прочности металлической связи. Она у разных металлов неодинакова, и особенно велика у тяжелых металлов с достраивающимся предпоследним электронным слоем атома, поэтому такие металлы отличаются высокой тугоплавкостью и высокой твердостью.
Температуры плавления металлов изменяются в очень широких пределах: от -39°С у ртути до 3410°С у вольфрама. Ртуть как единственный жидкий при обычных условиях металл применяется в измерительных приборах, вольфрам — во всех случаях, когда требуется металлический материал, противостоящий особенно высоким температурам, например для нитей накала электролампочек.
В широких пределах изменяется и твердость металлов: щелочные металлы мягки, как воск, а самые твердые из металлов, к которым относятся вольфрам и хром, не поддаются обработке закаленными напильниками.
К числу общих свойств металлов относится их растворимость друг в друге. Такие растворы металлов называются сплавами. Для каждого металлического изделия и каждой металлической детали подбирается или создается «по заказу» такой материал, который наилучшим образом удовлетворяет назначению изделия или детали. Среди чистых металлов такого материала, в котором сочетались бы все заданные свойства, обычно не находится, и тогда мы обращаемся к сплавам.
Так, в электролампочке, кроме вольфрама и цинка — из него изготовлен цоколь,- мы находим два сплава. Припой — легкоплавкий сплав свинца с сурьмой и оловом, из него состоит контакт лампочки и спай патрона с проволочкой, подводящей ток к нити накала, сама же эта проволочка из платинита — сплава железа с никелем, расширяющегося при нагревании одинаково со стеклом, вследствие чего она может впаиваться в стекло и при нагревании в месте спая не трескается (рис. 49).
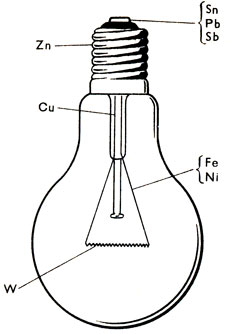
Рис. 49. В состав электролампочки входит семь металлов
