Азот при обычных условиях это
Азот — безжизненный газ, который так необходим для жизни
Содержание
- История открытия
- Способы получения
- Виды
- Жидкий азот
- Закись азота
- Газообразный азот
- Применение
- Применение в сварке
- Вредность и опасность
- Хранение и транспортировка
- Характеристики
- Коэффициенты перевода объема и массы N2 при Т=15°C и Р=0,1 МПа
- Коэффициенты перевода объема и массы N2 при Т=0°C и Р=0,1 МПа
- Азот в баллоне
- Давление азота в баллоне при различной температуре окружающей среды
История открытия азота
До сих пор ведутся споры о том, кто был первооткрывателем. В 1772 г. шотландский врач Даниель Резерфорд (Daniel Rutherford) пропуская воздух через раскаленный уголь, а потом через водный раствор щелочи — получил газ, который он назвал «ядовитый газ». Оказалось, что горящая лучинка, внесенная в сосуд, наполненный газом, гаснет, а живое существо в атмосфере этого газа быстро гибнет. Кстати, увидеть опыт с горячей лучинкой можно в видео.
В тоже время британский физик Генри Кавендшин (Henry Cavendish) проводя подобный опыт получил N2назвав его «удушливый воздух», британский естествоиспытатель Джозеф Пристли (Joseph Priestley) дал ему имя «дефлогистированный воздух», шведский химик Карл Вильгельм Шееле (Carl Wilhelm Scheele) — «испорченный воздух».
Окончательное имя «азот» дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier).
Слово «азот» греческого происхождения и означает «безжизненный».
Азот довольно легко поглощается раскаленным карбидом кальция, образуя при этом важный технический продукт — цианамид кальция и об этом уже писали в статье о получении ацетилена из карбида кальция.
Способы получения азота
Получение N2 в промышленных масштабах основано на производстве его из воздуха путем фракционной перегонки (см. получение азота).
Виды азота
Закись азота (N2O) не может быть получена из газообразного кислорода и N2, она образуется из азотнокислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
Газообразный азот относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м 3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм 3 /кг при давлении около 105 Па и температуре 20°C.
В отличие от кислорода, который взаимодействует почти со всеми элементами, встречающимися в природе, газообразный азот при комнатной температуре соединяется с единственным элементом — литием, образуя при этом нитрид лития:
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства и поэтому его концентрацию в зоне плавления стремятся ограничить.
Применение азота
Азот нашел применение во многих отраслях промышленности и ниже приведен небольшой список :
- для создания инертной атмосферы при производстве, хранении и транспортировке легко окисляемых продуктов;
- при высокотемпературных процессах (например — сварка и резка) обработки металлов, не взаимодействующих с азотом;
- для консервации замкнутых металлических сосудов и трубопроводов.
Применение азота в сварке
N2 является инертным по отношению к меди и ее сплавам (не растворяется в меди и не реагирует с ней) даже при высоких температурах. Азот применяют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%) для сварки меди и ее сплавов.

Также газ азот используют для сварки аустенитных нержавеющих сталей — исключительно как компонент защитной газовой смеси с аргоном.
Возникает логичный вопрос: «Если он образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание N2 увеличивает тепловую мощность дуги. Именно из-за этого свойства, его чаще всего используют не для сварки, а для плазменной резки.
При сварке полуавтоматом нержавейки добавление небольшого количества азота к смеси аргона с кислородом (95-97,5% Ar, 1% O2, 1,5-3% N2) позволяет добиться равномерной аустенитной структуры в сварных швах. При добавлении азота более 10% начинается обильное выделение дыма, но это не оказывает какого-либо негативного влияния на качество сварного шва нержавеющей стали.
При сварке полуавтоматом малоуглеродистых сталей содержание N2 в газовой смеси более 2% вызывает пористость при сварке в один проход. Концентрация N2 менее 0,5% вызывает пористость в сварном шве при многопроходной сварке.
Применение смеси Ar c высоким содержанием N2 для сварки меди и ее сплавов вызывает большое разбрызгивание метала сварочной ванны.
Вредность и опасность азота
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень кислорода в воздухе сокращается на 75% или становится ниже нормальной концентрации.
В больших количествах он очень вреден и опасен для организма человека.
Хранение и транспортировка азота
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный 1-го (99,6% N2) и 2-го (99,0% N2) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949.
Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.

Характеристики азота
Характеристики N2 указаны в таблицах ниже:
Азот (Nitrogene, N)

Азот — химический элемент, который известен каждому. Его обозначают буквой N. Он, можно сказать, основа неорганической химии, и поэтому его начинают изучать еще в восьмом классе. В этой статье мы подробно рассмотрим азот, а также его характеристики и свойства.
История открытия элемента
Такие соединения, как аммиак, селитра, азотная кислота, были известны и применялись на практике задолго до получения чистого азота в свободном состоянии.

Во время эксперимента, проведенного в 1772 году, Даниель Резерфорд сжигал фосфор и прочие вещества в колоколе из стекла. Он выяснил, что газ, остающийся после сгорания соединений, не поддерживает горения и дыхания, и назвал его «удушливым воздухом».
В 1787 году Антуан Лавуазье установил, что газы, входящие в состав обычного воздуха, — это простые химические элементы, и предложил название «Азот». Чуть позже (в 1784 г.) физик Генри Кавендиш доказал, что это вещество входит в состав селитры (группы нитратов). Отсюда происходит латинское название азота (от позднелатинского nitrum и греческого gennao), предложенное Ж. А. Шапталем в 1790 году.
К началу XIX века учеными были выяснены химическая инертность элемента в свободном состоянии и его исключительная роль в соединениях с другими веществами. С этого момента «связывание» азота воздуха стало важнейшей технической проблемой химии.
Физические свойства

Азот немного легче воздуха. Его плотность составляет 1,2506 кг/м³ (0 °С, 760 мм рт. ст.), температура плавления — -209,86 °С, кипения — -195,8 °С. Азот с трудом сжижается. Его критическая температура относительно низка (-147,1 °С), при этом критическое давление довольно высоко — 3,39 Мн/м². Плотность в жидком состоянии — 808 кг/м³. В воде этот элемент менее растворим, чем кислород: в 1 м³ (при 0 °С) Н₂О может раствориться 23,3 г N. Этот показатель выше при работе с некоторыми углеводородами.
Химические свойства азота
При нагревании до невысоких температур этот элемент взаимодействует только с активными металлами. Например, с литием, кальцием, магнием. С большинством других веществ азот вступает в реакцию в присутствии катализаторов и/или при высокой температуре.
Хорошо изучены соединения N с О₂ (кислородом) N₂O₅, NO, N₂O₃, N₂O, NO₂. Из них при взаимодействии элементов (t — 4000 °С) образуется оксид NO. Далее в процессе охлаждения он окисляется до NO₂. Оксиды азота образуются в воздухе при прохождении атмосферных разрядов. Их можно получить действием ионизирующих излучений на смесь N с О₂.

При растворении в воде N₂O₃ и N₂O₅ соответственно получаются кислоты HNO₂ и HNO₂, образующие соли — нитраты и нитриты. Азот соединяется с водородом исключительно в присутствии катализаторов и при высокой температуре, образуя NH₃ (аммиак). Кроме того, известны и другие (они довольно многочисленны) соединения N с H₂, к примеру диимид HN = NH, гидразин H₂N-NH₂, октазон N₈H₁₄, кислота HN₃ и другие.
Стоит сказать, что большинство соединений водород + азот выделены исключительно в виде органических производных. Этот элемент не взаимодействует (непосредственно) с галогенами, поэтому все его галогениды получают только косвенным путем. К примеру, NF₃ образуется при взаимодействии аммиака с фтором.
Большинство галогенидов азота — малостойкие соединения, более устойчивы оксигалогениды: NOBr, NO₂F, NOF, NOCl, NO₂Cl. Непосредственного соединения N с серой также не происходит, N₄S₄ получается в процессе реакции аммиак + жидкая сера. Во время взаимодействия раскаленного кокса с N образуется циан (CN)₂. В процессе нагревания ацетилена С₂Н₂ с азотом до 1500 °С можно получить цианистый водород HCN. При взаимодействии N с металлами при относительно высоких температурах образуются нитриды (к примеру, Mg₃N₂).
При воздействии на обычный азот электроразрядов [при давлении 130–270 н/м² (соответствует 1–2 мм рт. cт.)] и при разложении Mg₃N₂, BN, TiNx и Ca₃N₂, а также при электроразрядах в воздухе может быть образован активный азот, обладающий повышенным запасом энергии. Он, в отличие от молекулярного, весьма энергично взаимодействует с водородом, парами серы, кислородом, некоторыми металлами и фосфором.
Азот входит в состав довольно многих важнейших органических соединений, в том числе — аминокислот, аминов, нитросоединений и прочих.
Получение азота
В лаборатории этот элемент может быть легко получен в процессе нагревания концентрированного раствора нитрита аммония (формула: NH₄NO₂ = N₂ + 2H₂O). Технический метод получения N основан на разделении заранее сжиженного воздуха, который в дальнейшем подвергается разгонке.
Область применения

Основная часть получаемого свободного азота используется при промышленном производстве аммиака, который потом в довольно больших количествах перерабатывается на удобрения, взрывчатые вещества и т. п.
Кроме прямого синтеза NH₃ из элементов, применяется разработанный в начале прошлого века цианамидный метод. Он основан на том, что при t = 1000 °С карбид кальция (образованный накаливанием смеси угля и извести в электропечи) реагирует со свободным азотом (формула: СаС₂ + N₂ = CaCN₂ + С). Полученный цианамид кальция под действием разогретого водяного пара разлагается на CaCO₃ и 2NH₃.
В свободном виде данный элемент применяется во многих отраслях промышленности: в качестве инертной среды при разнообразных металлургических и химических процессах, при перекачке горючих жидкостей, для заполнения пространства в ртутных термометрах и т. д. В жидком состоянии он используется в различных холодильных установках. Его транспортируют и хранят в стальных сосудах Дьюара, а сжатый газ — в баллонах.
Широко применяют и многие соединения азота. Их производство стало усиленно развиваться после Первой мировой войны и на данный момент достигло поистине огромных масштабов.
Роль азота в биологии

Это вещество является одним из основных биогенных элементов и входит в состав важнейших элементов живых клеток — нуклеиновых кислот и белков. Однако количество азота в живых организмах невелико (примерно 1–3 % на сухую массу). Имеющийся в атмосфере молекулярный материал усваивают лишь сине-зеленые водоросли и некоторые микроорганизмы.
Довольно большие запасы этого вещества сосредоточены в почве в виде различных минеральных (нитраты, аммонийные соли) и органических соединений (в составе нуклеиновых кислот, белков и продуктов их распада, включая еще не полностью разложившиеся остатки флоры и фауны).
Растения отлично усваивают азот из грунта в виде органических и неорганических соединений. В природных условиях большое значение имеют особые почвенные микроорганизмы (аммонификаторы), которые способны минерализировать органический N почвы до солей аммония.
Нитратный азот грунта образуется в процессе жизнедеятельности нитрифицирующих бактерий, открытых С. Виноградским в 1890 году. Они окисляют аммонийные соли и аммиак до нитратов. Часть усвояемого флорой и фауной вещества теряется из-за воздействия денитрифицирующих бактерий.
Микроорганизмы и растения отлично усваивают как нитратный, так и аммонийный N. Они активно превращают неорганический материал в различные органические соединения — аминокислоты и амиды (глутамин и аспарагин). Последние входят в состав многих белков микроорганизмов, растений и животных. Синтез аспарагина и глутамина путем амидирования (ферментативного) аспарагиновой и глутаминовой кислот осуществляется многими представителями флоры и фауны.
Производство аминокислот происходит при помощи восстановительного аминирования ряда кетокислот и альдегидокислот, возникающих путем ферментативного переаминирования, а также в результате окисления различных углеводов. Конечными продуктами усвоения аммиака (NH₃) растениями и микроорганизмами являются белки, которые входят в состав ядра клеток, протоплазмы, а также откладываются в виде так называемых запасных белков.
Человек и большинство животных могут синтезировать аминокислоты лишь в довольно ограниченной мере. Они не способны производить восемь незаменимых соединений (лизин, валин, фенилаланин, триптофан, изолейцин, лейцин, метионин, треонин), и потому для них главным источником азота являются потребляемые с пищей белки, то есть, в конечном счете, — собственные белки микроорганизмов и растений.
Азот при обычных условиях это

Азот — весьма инертный химический элемент.
Содержание
[править] История открытия
В работе «Химический трактат о воздухе и огне» шведский химик К. Шееле описал получение и свойства «огненного воздуха» и отметил, что атмосферный воздух состоит из двух «видов воздуха»: «огненного» — кислорода и «флогистованого» — азота. Однако приоритет открытия кислорода принадлежит Джозефу Пристли, потому что труд Шееле был опубликован только в 1777 году.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота.
[править] Происхождение названия
Название «азот» (от греч. ἀζωτος — безжизненный, (на других языках: лат. Nitrogenium — то, что порождает селитру) предложено в 1787 Антуан Лавуазье, который в то время в составе группы других французских ученых разрабатывал принципы химической номенклатуры.
[править] Распространение в природе

Общее содержание азота в земной коре составляет 1 · 10 −2 % по массе. Основная его масса находится в воздухе. Сухой воздух содержит в среднем 78,09 % по объему (или 75,6 % по массе) свободного азота, соответствует общей массе 4 • 10 15 т. [1] В отношении малых количествах свободный азот находится в растворенном состоянии в водах океанов. В виде соединений с другими элементами (связанный азот) входит в состав всех растительных и животных организмов. Мощные месторождения азота в виде так называемой чилийской селитры известны лишь в Чили (Южная Америка). Кроме того, небольшие количества азота содержатся в почве, главным образом в виде органических соединений и солей азотной кислоты.
[править] Изотопы
Азот имеет два стабильных изотопа: 14 N (99,63 %) и 15 N (0,37 %). Искусственно получено 4 радиоактивных изотопа азота с массовыми числами 12, 13, 16, 17.
[править] Химические свойства
Азот входит в главной подгруппы пятой группы периодической системы Менделеева. Порядковый номер его 7. Атомы азота имеют во внешней электронной оболочке пять электронов. Поэтому они могут присоединять три электрона, которых им не хватает для образования полностью заполненной восемью электронами оболочки, и восстанавливаться до ионов N 3 или терять пять валентных электронов, превращаясь в положительно заряженные ионы и проявляя при этом свою максимальную положительную валентность. Атомы азота также могут терять и меньшее количество электронов, проявляя при этом положительную валентность 1+, 2+, 3+ и 4+.
Молекулы азота двухатомные, оба атома прочно связаны между собой тремя общими электронными парами.
Чтобы разложить молекулу азота на атомы, надо потратить значительное количество энергии. Поэтому азот при обычных условиях химически довольно пассивный.
При высоких температурах, когда молекулы азота разлагаются и он переходит в атомарное состояние, он сравнительно легко вступает в реакции с металлами (особенно с активными), образуя так называемые нитриды. При высокой температуре, высоком давлении и наличии катализатора оксид соединяется с водородом с образованием аммиака. При температуре электрической искры (свыше 3000 °C) азот реагирует с кислородом, образуя неустойчивый при высокой температуре монооксид азота NO по реакции:
В природе эта реакция происходит при грозовых разрядах.
[править] Другие свойства
В обычных условиях азот физиологически инертен, но при вдыхании сжатого воздуха наступает состояние, называемое азотным наркозом, подобное алкогольному опьянению. Эти случаи могут быть при условии водолазных работ на глубине нескольких десятков метров. Для предупреждения возникновения данного состояния порой пользуются искусственными газовыми смесями, в которых азот заменен гелием или иным инертным газом. При резком и значительном снижении парциального давления азота, растворимость его в крови и тканях настолько уменьшается, что часть его выделяется в виде пузырьков, является одной из причин возникновения кессонной болезни, которая наблюдается у водолазов при быстром их поднятии на поверхность и у пилотов при больших скоростях взлета самолета, а также при входе в верхние слои атмосферы.
В смеси с кислородом азот используется как слабый наркотик, вызывающий состояние опьянения, эйфории, притупление болевой чувствительности. Используется для ингаляционного наркоза.
[править] Получение

В лабораторных условиях чистый азот обычно получают путем разложения при нагревании раствора нитрита аммония по реакции:
Еще один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре 700 °C:
Аммиак берут из насыщенного раствора при нагревании, количество CuO в 2 раза больше расчетного. Непосредственно перед применением азот очищают от примесей кислорода и аммиака пропусканием над медью и ее оксидом (II), затем сушат концентрированной серной кислотой и сухой щелочью. Процесс достаточно медленный, но газ получается довольно чистый.
В промышленности азот в больших количествах добывают из воздуха с помощью азотных станций.
[править] Применение


Жидкий азот применяется как хладагент и для криотерапии.
Промышленное применение газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасный, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличение выработки месторождений. В горном деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия кислорода. Если в процессе, традиционно проходит с использованием воздуха, окисления или гниения являются негативными факторами — азот может успешно заменить воздух.
Большая часть получаемого в технике азота используется для производства аммиака.
В последнее время значительное распространение получило использование азота для создания инертной среды при проведении некоторых химических реакций, при перекачке горючих жидкостей и т. д.
Поскольку азот имеет низкую температуру кипения (77,4 К), то сжиженный азот является одним из главных криогенных жидостей.
Азот присутствует во многих взрывчатых веществах. Их свойства объясняются тем, что образование молекулы азота приводит к установлению очень прочной тройной связи, при этом высвобождается большое количество энергии.
Азот при обычных условиях это
АЗОТ, N (лат. Nitrogenium * а. nitrogen; н. Stickstoff; ф. azote, nitrogene; и. nitrogeno), — химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067. Открыт в 1772 английским исследователем Д. Резерфордом.
- Физические свойства и характиристика
- Соединение и взаимодействие
- Нахождение в природе
- Применение и использование
Свойства азота
При обычных условиях азот — газ без цвета и запаха. Природный азот состоит из двух стабильных изотопов: 14 N (99,635%) и 15 N (0,365%). Молекула азота двухатомная; атомы связаны ковалентной тройной связью NN. Диаметр молекулы азота, определённый разными способами, 3,15-3,53 А. Молекула азота очень устойчива — энергия диссоциации 942,9 кДж/моль.
Молекулярный азот
Константы молекулярного азота: f плавления — 209,86°С, f кипения — 195,8°С; плотность газообразного азота 1,25 кг/ м 3 , жидкого — 808 кг/м 3 .
Характеристика азота
В твёрдом состоянии азот существует в двух модификациях: кубической а-форме с плотностью 1026,5 кг/м 3 и гексагональной b-форме с плотностью 879,2 кг/м 3 . Теплота плавления 25,5 кДж/кг, теплота испарения 200 кДж/кг. Поверхностное натяжение жидкого азота в контакте с воздухом 8,5•10 -3 Н/м; диэлектрическая проницаемость 1,000538. Растворимость азота в воде (см 3 на 100 мл Н2О): 2,33 (0°С), 1,42 (25°С) и 1,32 (60°С). Внешняя электронная оболочка атома азота состоит из 5 электронов. Степени окисления азота меняются от 5 (в N2О5) до -3 (в NH3).
Соединение азота
Азот при нормальных условиях может реагировать с соединениями переходных металлов (Ti, V, Mo и др.), образуя комплексы либо восстанавливаясь с образованием аммиака и гидразина. С такими активными металлами, как литий, кальций, магний, азот взаимодействует при нагревании до сравнительно невысоких температур. С большинством других элементов азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения азота с кислородом: N2О, NO, N2О5. С водородом азот соединяется только при высокой температуре и в присутствии катализаторов; при этом образуется аммиак NH3. С галогенами азот непосредственно не взаимодействует; поэтому все галогениды азота получают только косвенным путём, например фтористый азот NF3 — при взаимодействии фтора с аммиаком. С серой также не происходит непосредственного соединения азота. При взаимодействии раскалённого кокса с азотом образуется циан (CN)2. При действии на обычный азот электрических разрядов, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азота, обладающих повышенным запасом энергии. Активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами.
Реклама
Азот — один из самых распространённых элементов на Земле, причём основная его масса (около 4•10 15 т) сосредоточена в свободном состоянии в атмосфере. Ежегодно при вулканической деятельности в атмосферу выделяется 2•10 6 т азота. Незначительная часть азота концентрируется в литосфере (среднее содержание в литосфере 1,9•10 -3 %). Природные соединения азота — хлористый аммоний и различные нитраты (селитры). Нитриды азота могут образовываться только при высоких температурах и давлениях, что, по-видимому, имело место на самых ранних стадиях развития Земли. Крупные скопления селитры встречаются только в условиях сухого пустынного климата (Чили, Индия, Египет, Испания и др.). Небольшие количества связанного азота находятся в каменном угле (1-2,5%) и нефти (0,02-1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1 %) и живых организмах (0,3%). Азот входит в состав белковых молекул и многих естественных органических соединений.
Круговорот азота в природе
В природе осуществляется круговорот азота, который включает цикл молекулярного атмосферного азота в биосфере, цикл в атмосфере химически связанного азота, круговорот захоронённого с органическим веществом поверхностного азота в литосфере с возвратом его обратно в атмосферу. Азот для промышленности ранее добывался целиком из месторождений природных селитр, число которых в мире весьма ограничено. Особенно крупные залежи азота в виде азотнокислого натрия находятся в Чили; добыча селитры в отдельные годы составляла более 3 млн. т.
Применение азота
Азот получают главным образом разделением предварительно сжиженного воздуха, который затем подвергается разгонке. Основная часть получаемого азота используется для производства аммиака, который затем перерабатывается на азотную кислоту, удобрения, взрывчатые вещества. Свободный азот применяют во многих отраслях промышленности как инертную среду при разнообразных химических и металлургических процессах. Жидкий азот находит применение в различных холодильных установках. Ведутся работы по использованию жидкого азота для замораживания неустойчивых пород (главным образом глинистых) при проходке шахтных стволов, в качестве безопасного энергоносителя для шахтных машин, а также для борьбы с рудничными пожарами, где применение азота позволяет резко снизить содержание кислорода в очаге пожара. При разработке нефтяных месторождений закачиванием азота в нефтяные пласты эффективно вытесняют нефть после заводнения. Азот используется также для поддержания давления в скважинах при бурении.
Азот (N)
Соединения азота:
Однозначано назвать ученого, который первым открыл азот не представляется возможным по той простой причине, что это практически одновременно сделали в 1772 году сразу трое — Генри Кавендиш, Джозеф Пристли и Даниэль Резерфорд (еще к этому списку можно причислить и Карла Шееле). Однако, ни один из ученых в свое время так и не понял до конца своего открытия. Многие «пальму первенства» отдают шотландцу Даниэлю Резерфорду, поскольку он первым опубликовал магистерскую диссертацию, в которой описал основные свойства «испорченного воздуха».
Собственно название «азот» было предложено в 1787 году А. Лавуазье.
Азот является четвертым самым распространенным химическим элементом Солнечной системы (после водорода, гелия и кислорода). Азот является одним из самых распространенных элементов на Земле:
- в земной атмосфере азота содержится 3,87·10 18 кг — 75,6% (по массе) или 78,08% (по объему);
- в земной коре азота содержится (0,7—1,5)·10 18 кг;
- в земной мантии азота содержится 1,3·10 19 кг;
- в гидросфере азота содержится 2·10 16 кг (7·10 14 кг в виде соединений).
Азот играет важнейшую роль в жизнедеятельности организмов — он присутствует в белках, аминокислотах, аминах, нуклеиновых кислотах.
Природный азот состоит из двух стабильных изотопов 14 N — 99,635% и 15 N — 0,365%.
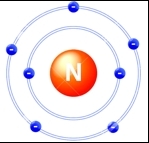
Атом азота содержит 7 электронов, которые располагаются на двух орбиталях (s и p) (см. Электронная структура атомов). На внутренней орбитали расположены 2 электрона; на внешней — 5 (одна свободная электронная пара + три неспаренных электрона, которые могут образовывать три ковалентные связи; см. Ковалентная связь).
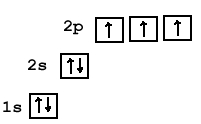
Вступая в реакции с другими химическими элементами, атом азота может проявлять степень окисления от +5 до -3 (кроме трех валентных электронов еще одна связь может образовываться по донорно-акцепторному механизму за счет свободной электронной пары с атомом, имеющим свободную орбиталь).
Степени окисления азота:
- +5 — HNO3;
- +4 — NO2;
- +3 — HNO2;
- +2 — NO;
- +1 — N2O;
- -1 — NH2OH;
- -2 — N2H4;
- -3 (самая распространенная) — NH3.
Три неспаренных р-электрона атома азота, лежащие на его внешнем энергетическом уровне, имеют форму равноплечей восьмерки, располагаясь перпендикулярно друг к другу:
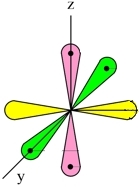
При образовании молекулы азота (N2) p-орбиталь, расположенная по оси X, одного атома, перекрывается с аналогичной px-орбиталью другого атома — в месте пересечения орбиталей образуется повышенная электронная плотность с формирование ковалентной связи (σ-связь).
Две другие орбитали одного атома, расположенные по осям Y и Z, перекрываются боковыми поверхностями со своими «собратьями» другого атома, образуя еще две ковалентные связи (π-связи).
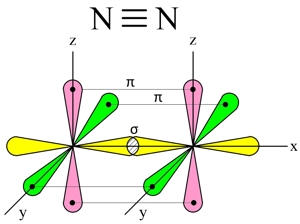
В итоге, в молекуле азота (N2) образуются 3 ковалентные связи (две π-связи + одна σ-связь), т. е., возникает очень прочная тройная связь (см. Множественные связи).
Молекула азота очень прочная (энергия диссоциации 940 кДж/моль), обладает низкой реакционной способностью.
Свойства молекулярного азота
В нормальных условиях азот является малоактивным веществом, что объясняется достаточно прочными межатомарными связями в его молекуле, поскольку образованы они аж тремя парами электронов. По этой причине, обычно азот вступает в реакции при высоких температурах.
- газ без запаха и цвета;
- плохо растворим в воде;
- растворим в органических растворителях;
- может реагировать с металлами и неметаллами при нагревании в присутствии катализатора (под воздействием ионизирующего облучения);
- азот вступает в реакции как окислитель (исключение составляют кислород и фтор):
- при нормальных условиях азот реагирует только с литием:
6Li + N2 = 2Li3N; - при нагревании азот реагирует с металлами:
2Al + N2 = 2AlN; - при температуре 500°C и при высоком давлении в присутствии железа азот реагирует с водородом:
N2 + 3H2 ↔ 2NH3; - при температуре 1000°C азот реагирует с кислородом, бором, кремнием:
N2 + O2 ↔ 2NO.
- при нормальных условиях азот реагирует только с литием:
- азот взаимодействует, как восстановитель:
- с кислородом:
N2 0 +O2 0 ↔ 2N +2 O -2 (оксид азота II) - с фтором:
N2 0 +3F2 0 = 2N+3F3 -1 (фторид азота III)
- с кислородом:
Получение и применение азота
Получение азота:
- промышленным способом азот получают сжижением воздуха с последующим отделением азота путем испарения;
- лабораторные способы получения азота:
- разложением нитрита аммония:
NH4NO2 = N2 + 2H2O; - восстановлением азотной кислоты активными металлами:
36HNO3 + 10Fe = 10Fe(NO3)3 + 3N2 + 18H2O; - разложением азидов металлов (чистый азот):
2NaN3 → (t) 2Na + 3N2; - атмосферный азот получают реагированием воздуха с раскаленным коксом:
O2 + 4N2 + 2C → 2CO + 4N2; - пропусканием аммиака над оксидом меди (II) при t=700°C:
2NH3 + 3CuO → N2 + 3H2O + 3Cu.
- разложением нитрита аммония:
Применение азота:
- создание инертных сред в металлургии;
- синтез аммиака и азотной кислоты;
- производство взрывчатых веществ;
- для создания низких температур;
- производство минеральных удобрений: калийная селитра (KNO3); натриевая селитра (NaNO3); аммонийная селитра (NH4NO3); известковая селитра (Ca(NO3)2).
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе
