Где взять соляную кислоту в домашних условиях?
Как получить соляную кислоту в домашних условиях: свойства и применение

Соляная кислота, не смотря на свои опасные, на первый взгляд, свойства является естественным компонентом пищеварительной системы человека. Вещество содержится в составе желудочного сока и принимает участие в расщеплении пищи перед ее дальнейшим поступлением в кишечник. В настоящий момент кислота широко применяется в медицине для лечения заболевания желудка.
Свойства и функции
К сожалению, далеко не каждый человек знает о важности соляной кислоты для здоровья. В большинстве случаев специальные диагностические процедуры для выявления уровня кислотности содержимого желудка выполняются при наличии патологии.

- Расщепление пищи. За счет соляной кислоты в желудке происходит распад питательных веществ на простые компоненты. Это способствует их лучшему всасыванию кишечником и дальнейшему усвоению тканями и клетками. Также кислота разбивает белковые соединения на аминокислоты, что повышает их биологическую доступность.
- Защита от инфекции. Соляная кислота, вырабатываемая в желудке париетальными клетками, защищает орган от бактерий и грибков. Исключением являются бактерии хеликобактер пилори, которые провоцируют гастрит. Такая инфекция устойчива к действию соляной кислоты, а потому поражают оболочку желудка.
- Противопаразитарная функция. Аналогично с бактериями, соляная кислота препятствует развитию глистов, яйца которых попадаю в желудок вместе с пищей. Вещество также воздействует на взрослых паразитов, а потому они практически никогда не обитают в желудке.
- Образование казеина. Соляная кислота отвечает за ферментативное створаживание в желудке. Это значит, что под действием вещества ранее употребляемое молоко превращается в казеин, который является ценным источником белка, содержащим все группы аминокислот.
- Активизация гастриксина. Вещество представляет собой фермент, расщепляющий белковые соединения. Под действием соляной кислоты гастриксин активизируется, что в свою очередь приводит к стимуляции работу нижних пищеварительных отделов.
В целом, соляная кислота выполняет важные функции в организме человека, обеспечивая полноценное переваривание пищи.
Причины и признаки снижения кислотности желудка

Кислотность желудка – это физиологическая характеристика, отражающая концентрацию соляной кислоты в составе соков. Понижение кислотности происходит вследствие замедления выработки кислоты.
Данное нарушение происходит по следующим причинам:
- Заражение бактериями хеликобактер пилори
- Атрофические процессы в слизистой оболочке
- Низкий обмен веществ на фоне заболевания щитовидной железы
- Онкологические поражения и лучевая терапия
- Заболевания поджелудочной железы
- Иммунный гастрит
- Низкое содержание цинка, дефицит витамина В1 и РР
Вероятность снижения уровня pH в желудке возрастает у людей, которые неправильно питаются, часто используют диеты или голодают. Риск нарушения существует при избыточном потреблении углеводов, наличии хронических заболевания кишечника, в пожилом возрасте.
Снижение секреции соляной кислоты не протекает бессимптомно. У пациентов с нарушением кислотности возникают различные пищеварительные расстройства.
В их число входят следующие:
- Регулярная отрыжка с неприятным привкусом
- Тошнота
- Тянущая боль в животе
- Усиленное газообразование

- Расстройства кишечника
- Неприятный запах изо рта
- Присутствие в каловых массах частичек непереваренной пищи
- Заброс содержимого желудка в пищевод
- Изжога
Наличие симптомов указывает на низкое содержание соляной кислоты. При длительном нарушении кислотности развиваются инфекционные заболевания. У некоторых пациентов отмечают сухость кожи, слабость и онемение конечностей, депрессии.
Повышение кислотности желудка
Лечение низкой кислотности производится путем применения специальных препаратов. Терапия назначается только гастроэнтерологом, так как самостоятельное лечения не помогает восстановить кислотность желудка. Многие пациенты выбирают неправильные лекарственные средства, чье действие нейтрализует кислоту, усугубляя состояние больного.
В целях лечения используют препараты, содержащие соляную кислоту, или же раствор, который принимается в жидком виде. Многих интересует вопрос как получить соляную кислоту в домашних условиях. Данный процесс достаточно сложный, требует знаний в области химии и наличие специального оборудования и материалов, а потому домашнее изготовление вещества является небезопасным и редко оказывается успешным.
В медицинских целях может использоваться концентрированный желудочный сок животных. Его принимают, как и раствор соляной кислоты, непосредственно во время приема пищи. В целях повышения кислотности также назначаются ферментные препараты, способствующие повышению кислотности и активизируют пищеварительные процессы.
Таким образом, кислотность желудка нормализуется с помощью раствора соляной кислоты и препаратов на ее основе.
Во время просмотра видео вы узнаете о кислотности желудка.
Соляная кислота – неотъемлемый компонент желудочного сока, отвечающий за расщепление пищи и защиту желудка от бактерий. Низкая выработка соляной кислоты приводит к снижению кислотности, из-за чего могут возникать разные заболевания.
Соляная кислота
#1 Tim_


Продолжаем цикл статей бытовой химии 😉
По традиции начну с краткого описания приготовляемого вещества:
Соляная кислота, иначе раствор хлороводорода HCI в воде. Едкая бесцветная жидкость с резким неприятным запахом, относительно безопасна при попадании на кожу, при условии что быстро смоете большим количеством воды. Дымит во влажном воздухе. Сам хлороводород представляет собой бесцветный газ с резким запахом, легко растворимый в холодной воде и плохо — в горячей. Отсюда делаем вывод — чтобы получить соляную кислоту нужно получить хлороводород и растворить его в холодной воде, чем холоднее вода тем более концентрированная кислота получится, максимально
Ингредиенты для получения:
1. Серная кислота H2SO4 . Если нет концентрированной, можно использовать электролит для свинцовых аккумуляторов плотностью 1,28 или 1,40 (корректирующий).
2. Хлорид натрия (поваренная соль) лучше каменную соль, не очищенную, без каких либо добавок (йод и т.д.) В общем самую дешевую.
Получение:
1. Упаривание электролита если нет концентрированной серной кислоты. Берем электролит, наливаем в любую подходящую колбу, лучше плоскодонную коническую Эрленмеера, бросаем пару – тройку кусочков неглазурованного фарфора или просто кусочки битого красного кирпича (для спокойного кипения без выбросов пара). Колбы ставим в сковороду с речным песком и упариваем на обычной газовой плите. При этом за процессом желательно следить, как только пар, выходящий из колбы станет едким и вонючим, процесс прекращаем. Охлаждаем, переливаем в емкость для хранения. Теперь у нас есть серная кислота концентрацией 75-85%.
2. Собираем прибор для перегонки как на рисунке ниже, для этого нам понадобится колба Вюрца и большая воронка, чем больше тем лучше, желательно прозрачную, чтобы через нее было видно уровень жидкости в которую воронка погружена. Так же как и с серной кислотой колбу ставим в сковороду с песком, немного закапываем ее, но чтобы между дном сковороды и дном колбы оставалась прослойка песка, иначе лопнет. Отвод колбы соединяем с воронкой резиновым или ПВХ шлангом. Воронку опускаем в широкий плоский сосуд вверх носиком, к которому подсоединена трубка от колбы, сосуд желательно стеклянный, пройдитесь по магазинам и купите что-нибудь подходящее. Почему должен быть именно стеклянный? — Стекло хорошо проводит тепло и не разъедается кислотами. Этот сосуд ставим в таз с холодной водой и добавляем снег или лед для охлаждения первого сосуда — приемника. Помните — чем холоднее вода для кислоты тем лучше растворяется в ней хлороводород.
3. Загружаем в колбу Вюрца поваренную соль и заливаем кислотой (кислоту лучше вливать не сразу, а по частям), закрываем пробкой, наливаем в приемник воды, при том столько, что бы при засасывании ее в воронку при растворении хлороводорода она не переплеснулась в колбу Вюрца, т.е. меньше объема воронки. Нагреваем. Сначала из вод воронки будут выходить пузыри, это воздух расширяется, но потом если сильно греете может пойти и не успевший раствориться хлороводород, так что за температурой лучше следить. По этой же причине нельзя вливать всю серную кислоту сразу. Смотря как собран прибор, если герметично — можно дома, если воняет, лучше на улице или в мастерской. В результате выделяющийся хлороводород растворяется в воде в приемнике, получается кислота. Все просто.
Как видите процесс еще доступнее, чем с азотной кислотой, единственное что понадобится — колба Вюрца, но как вы уже наверное догадались можно воспользоваться способом для жадных и использовать обычную бутылку с пробкой и трубкой для отвода хлороводорода.
Рисунок не могу найти, самому рисовать некогда да и не в чем, выложу как откопаю.
#2 Korobtsov






- Пол: Мужчина
- Город: Костанай
Соляная кислота, иначе раствор хлороводорода HCI в воде.
2NaCI + H2SO4 = Na2SO4 + 2HCI[/center
Как видите процесс еще доступнее, чем с азотной кислотой, единственное что понадобится — колба Вюрца, но как вы уже наверное догадались можно воспользоваться способом для жадных и использовать обычную бутылку с пробкой и трубкой для отвода хлороводорода.
Рисунок не могу найти, самому рисовать некогда да и не в чем, выложу как откопаю.
Насколько концентрированную кислоту можно получить таким способом?
#3 Tim_


При должном усердии и аккуратности вплоть до такой, которую даже не сможете купить. Только зачем? 28-30% достаточно для любых нужд.
#4 С ВИКТОР С



- Пол: Мужчина
- Город: Планета Земля
 tutankanara
tutankanara
Живой Журнал
Сергея Подгорных
— В продолжениие темы о юных химиках.
Многие начинающие (и не начинающие) химики задаются вопросом: «А где же взять реактивы?» Оглянитесь! Они вокруг вас! Не верите? Тогда читайте дальше
Итак, начнем. (Это далеко не полный список реактивов, которые можно найти)
ГДЕ ДОСТАТЬ МЕТАЛЛЫ
Алюминиевая пудра — серебрянка. Бывает, продаётся хозмагах(там же где и краски)
Литий Li — встречается в пальчиковых батарейках ENERGIZER Lithium
Натрий Na — в выпускных клапанах двигателей внутреннего сгорания ЗИЛ
Никель Ni — в некоторых батарейках (никелевый стакан)
Свинец Pb — продается в рыболовном магазине как грузило или как пули для пневматичекого оружия (Не шарики!) .
Так же, можно использовать дробь или свинцовые пластины из аккумуляторов (везде содержатся примеси!)
Олово Sn — продается в радиотоварах (припой), но это сплав. Так же, можно поискать и чистое олово( цена его высока) в тех же радиомагах или в химмагах.
Отличительная особенность чистого олова от его сплавов: пруток его хрустит, будучи погнутым
Магний Mg — в магазине под названием магниевые аноды на боллер. Также картеры автомобилей ЗАЗ изготовлены из этого металла, а точнее из сплава электрон.
Серебро Ag — в виде серебряного лома (ложки, кольца и т.п.) Почти во всех случаях — это сплав, для получения чистого серебра необходимо производить очистку
ГДЕ ДОСТАТЬ КИСЛОТЫ
Серная кислота H2SO4 — продается в автомагазинах как кислотный электролит для аккумуляторов (25-30% раствор)
Ортофосфорная кислота H3PO4 — продается как преобразователь ржавчины или флюс для пайки (Читайте состав!)
Уксусная кислота CH3COOH — обычная уксусная эссенция (70%), продается в любом продуктовом магазине
Кремниевая кислота H2SiO3 — легко изготовить самому: к силикату натрия или калия (канц. клей) приливается любая кислота — выпадает осадок нерастворимой в воде кремниевой кислоты
Борная кислота H3BO3 — продается в аптеке
Лимонная кислота (HOOCCH2)2C(OH)COOH — продается в продовольственных магазинах
Соляная кислота HCl — можно достать на рынке, но маловероятно (прекурсор на территории РФ)
ГДЕ ДОСТАТЬ ОСНОВАНИЯ
Гидроксид натрия NaOH продается в смеси с посторонними веществами в отделе бытовой химии как чистящее средство «крот» (Избегать долгого контакта с воздухом, т.к. гидроксид натрия на воздухе превращается в карбонат! Вдобавок набухает и расплывается)
Гидроксид алюминия Al(OH)3 легко получить самому: к раствору сульфата алюминия приливается раствор гидроксида натрия (избегать избытка гидроксида натрия, т.к. гидроксид алюминия амфотерное основание и в избытке щелочи растворяется, образуется тетрагидроксоалюминат натрия(Na[Al(OH)4]). По этой же причине алюминий растворяется в едких щелочах с образованием всё тех же тетрагидроксоалюминатов. )
Гидроксид цинка Zn(OH)2 получается таким же способом, только берется раствор сульфата цинка (гидроксид цинка тоже амфотерное основание)
Гидроксид меди Cu(OH)2 получается таким же способом, только берется раствор сульфата меди
Раствор аммиака в воде NH4OH — (слабое основание) продается в аптеке как нашатырный спирт или в хоз. магазинах 25% раствор(теперь его достаточно сложно найти — остался 10% в стеклянных бутылках)
Керосин — в хозмаге, применяется как растворитель
Мочевина (или карбамид) (NH2)2CO — продаётся в хозмагах в качестве азотного удобрения. В последнее время, многие удобрения встречаются гуматизированными(оч. грязная: небольшое количество целевого вещества, намешанного с землёй)
Уротропин( (CH2)6(NH2)4 или C6H12N4 ) — продаётся загрязнённым в виде сухого горючего( толстые таблетки ) в хозмагах или охотничьих магазинах.
Сера S — в хозмагах как средство для окуривания теплиц, подвалов и т.п. (комковая сера) Загрязнена всевозможными примесями, как коллоидная сера для приготовления суспензии против цветочных клещей — я брал компании Грин Бэлт в пакетиках по 30г — она дороже комковой серы, но значительно чище.
Толуол C6H5CH3 — продается в хоз.магазине как растворитель 646. Необходима перегонка т.к. это многокомпонентный растворитель с содержанием толуола около 50%
Нитрат аммония NH4NO3 — аммиачная селитра.
Нитрат калия KNO3 — калиевая селитра.
Нитрат натрия NaNO3 — натриевая селитра.
Нитрат кальция Ca(NO3)2 — кальциевая селитра.
Нитрат серебра AgNO3 раньше продавался в аптеках под названием ляпис, но сейчас его сняли с производства.
Нитрат свинца Pb(NO3)2 — получается сплавлением аммиачной селитры с окисью свинца( выделяется много газов, окись добавлять постепенно при активном помешивании)
Хлорид натрия NaCl — это обычная поваренная соль, продается в любом продуктовом магазине
Хлорид калия KCl — в хоз. магазине как удобрение, но там очень много примесей(профильтровать будет нелишним).
Хлорид аммония NH4Cl — средство для пайки (флюс) Читайте состав! (в простонародье нашатырь)
Хлорид кальция (CaCl2) — продается в аптеке (раствор в ампулах). Можно получить нагреванием смеси нашатыря с известью
Иодид калия KI — продается в аптеке как средство против йододефицита (Почитайте аннотацию препарата перед тем как купить, потому что может быть другой состав!)
Сульфат калия K2SO4 — продается в хоз. магазине как удобрение (примесей тоже много)
Сульфат меди или медный купорос CuSO4 — продается в хоз. магазинах( синие кристаллы )
Сульфат магния или магнезия (горькая соль) MgSO4 продается в аптеке в качестве слабительного или в хозмагах как удобрение
Сульфат аммония (NH4)2SO4 может продаваться в хоз. магазинах как удобрение, но его просто изготовить и самому: к раствору аммиака (раствор аммиака берется в небольшом избытке) приливается раствор серной кислоты (смесь разогревается). Если емкость где проходила реакция постоит сутки на воздухе, то избыток аммиака улетучится — получается раствор сульфата аммония. Если требуется получить в твердом виде то можно (как я делал) на крышку из под сыра или масла это выливается и сушится где-то 2-3 суток (этот метод более деликатный, чем выпаривание)
Сульфат железа(III) Fe2(SO4)3 в принципе можно получить так же, как указано выше, только берется железный гвоздь/канц. скрепка (при этом емкость пачкается — покрывается желтым налетом) или окислением железного купороса (сульфата железа(II)) перекисью водорода
Сульфат никеля NiSO4 получается так же, как указано выше, только берется никелевая пластинка.
Сульфат цинка ZnSO4 получается так же, как указано выше, только берется цинковая пластинка.
Гидрокарбонат натрия NaHCO3 — обычная пищевая сода
Карбонат кальция CaCO3 — обычный мел (примеси тальк и др.) или мрамор
Ацетат свинца Pb(CH3COO)2 продается в аптеке как свинцовые примочки.
Можно, так же, получить его растворением свинца(или его окиси) в уксусной кислоте( при добавлении перекиси, реакция пойдёт быстрей)
Ацетат натрия CH3COONa получается приливанием уксусной кислоты к карбонату натрия( не важно, к какому). Раствор, почти не пенящийся после приливания очередной порции у.к, подогревают или оставляют на несколько дней в какой-нибудь открытой ёмкости( чтоб излишки уксусной кислоты выветрились ) и, по возможности, упаривают до начала кристаллизации.
Получение соляной кислоты в домашних условиях

Алхимики, впервые получившие соляную кислоту в 15 веке, назвали её «spiritus salis», «дух из соли». Эта кислота обладала на тот момент волшебными свойствами: разъедала бумагу, растворяла металлы, отравляла людей. Эти свойства остались у неё и по сей день, но сейчас эта кислота достаточно изучена, и волшебства здесь нет.
Соляная кислота (HCl) — сильная одноосновная кислота, в чистом виде — прозрачная жидкость. При своей максимальной концентрации 38% «дымит» на воздухе. Мы же будем получать кислоту с концентрацией вдвое меньшей.
Техника безопасности
Осторожно, работа с ядовитыми веществами!
Все опыты необходимо проводить в хорошо вентилируемом помещении либо под вытяжкой, Обязательно в защитных очках (можно приобрести в строй. магазине) и перчатках (если не найдёте специальные химические перчатки, подойдут хорошего качества для мытья посуды).

На месте проведения опыта обязательно должна присутствовать пищевая сода, чтобы в непредвиденной ситуации нейтрализовать ею кислоту (при этом выделится углекислый газ и вода).
Строго запрещено проводить эксперимент в металлической посуде.
Понадобится
Для проведения опыта нам потребуется:
- Кислотный электролит для аккумуляторов (продаётся в автомагазине);
- Дистиллированная вода (там же);
- Поваренная соль (есть на любой кухне);
- Пищевая сода (см. технику безопасности).

Из посуды необходимо:
- Стеклянная колба;
- Сосуд с песком, куда можно колбу поместить;
- Несколько одноразовых стаканчиков 200 мл;


Если Вы располагаете термостойкой колбой, то можно нагревать её под открытым пламенем горелки. Но всё же рекомендую через песок, в случае чего он впитает в себя кислоту.
Также понадобятся пара сантехнических уголков диаметром 50 мм и горелка (в моём случае спиртовая, но рекомендую использовать газовую).

1 этап — выпаривание
Электролит для аккумуляторов — самая что ни на есть 36%-ая серная кислота (H2SO4). Вначале нам необходимо повысить её концентрацию.
Наливаем в стаканчик 200 мл, то есть почти до краёв и переливаем чуть больше половины стаканчика в колбу. Делаем маркером метку и доливаем остальное.

Поставил вокруг колбы отражатель из фольги для более эффективного нагревания, но позже снял, ибо начал плавиться.
Теперь ставим колбу на горелку и выпариваем до уровня поставленной ранее метки, даже чуть ниже.

Параллельно надеваем на уголок сложенную в несколько раз марлю и фиксируем резинкой. Готовим ненасыщенный раствор соды и макаем в него конец уголка с марлей.

Когда электролит начнёт кипеть, надеваем на колбу уголок, он плотно на неё садится. Марлевый конец направляем в открытое окно.

Это необходимо, если вдруг вместе с водой начнёт испаряться сама серная кислота. Если сильно не перегревать колбу, этого не произойдёт.
Горелка в действии:

Мощность моей горелки сравнительно мала, поэтому выпаривание заняло около часа. Газовая горелка или электрическая плита значительно бы ускорили этот процесс.
После завершения первого этапа в колбе должно остаться чуть меньше половины раствора, то есть кислота концентрацией около 75%. Не забываем про аккуратность.

Даём ей остыть до комнатной температуры.
2 этап — вычисления
Теперь, когда у нас есть концентрированная серная кислота, можем провести основную реакцию, она выглядит следующим образом:
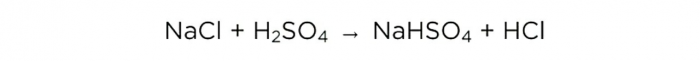
Но прежде давайте проведём некоторые вычисления, а в конце сравним их с тем, что получилось на практике.
Итак, изначально у нас было 200ml электролита плотностью 1,27 г/см³. Заглянув в таблицу плотностей серной кислоты увидим, что данная плотность соответствует концентрации 36%. Вычислим объём кислоты:
После того, как мы выпарили раствор, его концентрация, а соответственно, и плотность увеличилась. Глядим в ту же таблицу и видим, что концентрации 75% соответствует плотность 1,67 г/см³.
Зная текущую плотность(p) и объём(V) кислоты узнаем массу:
Теперь из школьной химии вспоминаем:
где M — молярная масса вещества.
Молярные массы H2SO4, NaCl и HCl соответственно равны 98, 58.5 и 36.5 г/моль. Теперь мы можем узнать, сколько понадобится поваренной соли и сколько получится HCl.
А именно нам понадобится 72г NaCl, это 34 мл, возьмём в избытке — четверть стаканчика.
Отлично, а HCl в теории выйдет 44,7г.
В таблице плотностей HCl есть столбец г/л. Берём оттуда значение для концентрации 15% — 166,4 г/л. Объём воды, необходимый для получения 15% HCl равен 44,7/166,4≈270ml. Мы возьмём 200ml. В итоге в теории у меня выйдет 22%-ная соляная кислота.
3 этап — получение кислоты
Соединяем два уголка следующим образом:

А вся конструкция будет выглядеть так:

В сосуд с надписью HCl будет конденсироваться соответствующая кислота, объём воды в нём — 200ml. Также на этом сосуде отметьте текущий уровень жидкости.
Снимаем уголки и через воронку засыпаем в колбу вычисленное в расчётах количество соли.


Чтобы соляная кислота начала выделяться, необходимо включить горелку. Но вначале плотно присоединяем к колбе и получающему сосуду уголки.
При конденсации кислоты в воде, образуются “вертикальные волны”. Также при этом раствор нагревается, и его надо охлаждать. Например, можно снизу поставить ещё один сосуд со льдом.
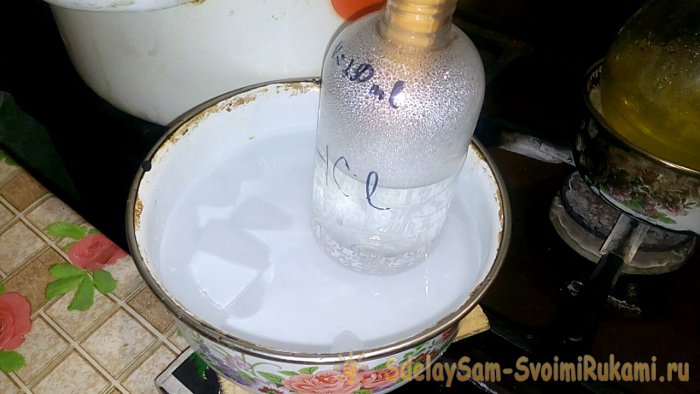
Реакция протекает относительно быстро — 20 минут, после чего можно выключать огонь. Даём последним парам соляной кислоты раствориться в воде, после чего герметично закрываем сосуд. Когда колба остынет, разбавляем оставшийся там раствор водой (примерно один к одному) и сливаем его в канализацию.

По метке на сосуде определяем, сколько жидкости прибавилось. У меня это ⅙, то есть 17%. Это и есть концентрация нашей соляной кислоты. Сравним её с той, которая получается в теории.
Важно отметить, выхода равного 1 не бывает, всегда есть потери. В моём случае это недостаточно выпаренный электролит. В идеале концентрация серной кислоты должна быть 90-95%.
Проверим получившуюся кислоту на взаимодействие с металлом.

Наблюдаем бурное выделение водорода. Это означает, что кислота пригодна для дальнейших экспериментов.
Вариации
В качестве колбы можно воспользоваться чистой стеклянной бутылкой из-под пива или газировки, но при условии, что нагревание будет максимально плавным. Вместо ПВХ уголков можно взять полипропиленовые трубы и уголки меньшего диаметра (подходящего под Вашу колбу).
Ещё раз призываю соблюдать технику безопасности. Всем удачных опытов!
Соляная кислота: описание вещества и применение в хозяйстве
Краткие характеристики

Лимонку применяют для приготовления напитков, чтобы придать слегка кисловатый вкус, способный утолить жажду. Добавление в консервированные продукты позволяет продлить срок годности, а десерты, в состав которых вошла лимонная кислота, приобретают незабываемый оттенок вкуса.
Первые образцы данной пищевой добавки были добыты из лимонного дерева. После, некоторые ученые смогли ее выделить из незрелых плодов лимона и других цитрусовых, различных ягод и даже из хвойных пород деревьев. В настоящее время добавка производится искусственным путем – синтезируя сахаристые вещества со штаммом плесневого грибка.
Внешне пищевая добавка представляет собой порошок белого цвета кристаллической формы. В реализацию поступает в небольших, герметично запаянных бумажных упаковках различного весового размера.
Название продукта отображает вкусовые качества, который характеризует его, как концентрированный лимонный сок. Пытаясь различить запах лимонной кислоты, улавливается слегка кисловатый оттенок, который пропадает после продолжительного нахождения упаковки в открытом состоянии.
Взаимодействие с другими веществами
Кроме перечисленного, соляная кислота может вступать в реакции и с соединениями иных типов. В частности, с:
- Солями металлов, которые образованы другими, более слабыми кислотами. Вот пример одной из таких реакций: Na2Co3 + 2HCl → 2NaCl +Н2О + СО2↑. Здесь показано взаимодействие с солью, образованной угольной кислотой (Н2СО3).
- Сильными окислителями. С диоксидом марганца, например. Или с перманганатом калия. Сопровождаются такие реакции выделением хлора. Вот один из примеров: 2KMnO4 +16HCl → 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2О.
- Аммиаком. Это – нитрид водорода с формулой NH3, представляющий собой бесцветный, но резко пахнущий газ. Следствие его реакции с раствором соляной кислоты – масса густого белого дыма, состоящего из мелких кристаллов хлорида аммония. Который, кстати, всем известен, как нашатырь (NH4Cl).Формула взаимодействия следующая: NH3 + HCl → NH4CL.
- Нитратом серебра – неорганическим соединением (AgNO3), являющимся солью азотной кислоты и металла серебра. Вследствие контакта с ним раствора соляной кислоты возникает качественная реакция – образование творожистого осадка хлорида серебра. Который не растворяется в азотной. Выглядит это так: HCL +AgNO3 → AgCl↓ + HNO3.
На что обращать внимание при выборе «Лимонки»

- Герметичность упаковки – это основной показатель, на который необходимо обратить внимание при покупке лимонной кислоты. Нарушенная герметичность упаковки может говорить о неправильном хранении или транспортировки товара.
- Также обратите внимание на сухость упаковочного материала. Влажная среда вызывает комкование и уплотнение порошкообразного вещества. Это является следствием потерь положительных качеств лимонной кислоты.
- Еще один важный критерий, который также нуждается во внимании – это срок годности продукции. Истечение срока не приведет ни к каким внешним изменениям кислоты, но сделает продукт абсолютно бесполезным и лишенным вкуса.
Ожоги и отравление
Каким бы эффективным ни было это средство, оно опасно. Соляная кислота, в зависимости от концентрации, может спровоцировать химические ожоги четырех степеней:
- Возникает лишь покраснение и боль.
- Появляются пузыри с прозрачной жидкостью и отек.
- Формируется некроз верхних слоев кожи. Пузыри заполняются кровью или мутным содержимым.
- Поражение достигает сухожилий и мышц.
Если вещество каким-то образом попало в глаза, надо промыть их водой, а потом содовым раствором. Но в любом случае первым делом надо вызвать скорую.
Попадание кислоты внутрь чревато острыми болями в груди и животе, отеком гортани, рвотными кровавыми массами. Как следствие – тяжелые патологии печени и почек.
А к первым признакам отравления парами относят сухой частый кашель, удушье, повреждение зубов, жжение в слизистых оболочках и боли в животе. Первая неотложная помощь – это умывание и полоскание полости рта водой, а также доступ к свежему воздуху. Настоящую помощь может оказать лишь токсиколог.
Приготовление лимонной кислоты в домашних условиях

Процесс изготовления «Лимонки» дома, требует терпения и времени. Но пищевая добавка, изготовленная в домашних условиях, несколько отличается своим внешним видом от производственного аналога.
- Выжмите сок лимона. Для этого подойдет соковыжималка или можно воспользоваться простым методом – разрезав плод на половинки, выдавить сок руками.
- Подготовьте две посудины: одну глубокую, а вторую мелкую.
- В глубокую тару налейте воды. Она будет использоваться для создания водяной бани.
- Процедите сок через марлю и отделите от мякоти и косточек.
- Залейте в неглубокую посуду.
- Поставьте кастрюлю с водой на огонь и доведите содержимое до кипения.
- Установите мелкую посуду внутрь кастрюли.
- Выпаривайте до тех пор, пока жидкая часть сока не испарится, а на поверхности останутся лишь кристаллы.
Таким нехитрым способом, можно получить лимонную кислоту в домашних условиях, имеющую некоторые отличия от покупной продукции.
Производство соляной кислоты
Данное вещество получают путем полного растворения хлороводорода в виде газа в обычной водной среде. А вот сам хлороводород появляется в результате сжигания водорода в хлоре. Полученное таким образом соединение называется синтетическим. Еще рассматриваемую кислоту можно получить из специальных абгазов — побочных газов, которые появляются при разных процессах. К примеру, при хлорировании углеводородов. Важно отметить, что хлороводород, который имеется в составе этих газов, называется абгазным. В последние годы количество абгазной кислоты в объеме производства постоянно увеличивается, вытесняя кислоту, которую получают методом сжигания водорода в хлоре. Но, все же, полученная таким простым методом соляная кислота имеет в составе меньше посторонних ингредиентов и задействуется при необходимости достижения максимальной чистоты. Хлороводород хорошо растворяется в воде.
Вконтакте










Как используется лимонная кислота в кулинарии

Эту пищевую добавку включают во множество блюд и напитков. Вот небольшой список кулинарных хитростей:
- Корректируем вкус блюда. Лимонная кислота используется для корректировки вкусовых качеств первых, вторых блюд и напитков, когда необходимо добавить чуточку кислинки.
- Лимонная вода. Для того чтобы сделать лимонную воду, необходимо на 100 миллилитров воды добавить 4 грамма пищевой добавки.
- Готовим шипучку. Размешайте 1 чайную ложку соды с 3 чайными ложками кислоты. Добавьте в содержимое 1 столовую ложку сахарной пудры и перемешайте до образования однородной массы. Эта смесь используется для приготовления «шипучки»: 1 столовая ложка на 200 миллилитров воды.
В каких блюдах используется лимонная кислота?

- Борщ. В данном случае, кислота выполняет сразу две функции: первая – это придания блюду пикантного вкуса, а вторая – для яркого и насыщенного цвета, присущего красной свекле. Кислота добавляется во время овощной поджарки.
- Консервация. Добавив лимонку в варенье, увеличивается продолжительность срока хранения и улучшаются вкусовые качества продукции. Если варенье готовится из абрикосов, груш или яблок, то на 1 килограмм плодов добавьте половину чайной ложки порошка. Только не забудьте, что кислоту добавляют за 5 минут до готовности варенья. Также можно использовать во время приготовления компотов и салатов с соблюдением необходимых пропорций.
- Вино. В некоторых случаях возможно добавление кислоты в сусло, из которого изготавливаются вина и винные напитки.
- Водка. Чтобы смягчить неприятный вкус водочной продукции, добавьте 3 грамма лимонной кислоты на 10 литров водки.
- Выпечка. Придает аромат и вкус испеченной продукции, и способствует умягчению мякиша. Благодаря лимонной кислоте, приготовление выпечки проводится быстрее.
Реакции с оксидами
С данными веществами раствор кислоты соляной тоже прекрасно взаимодействует. Оксиды – это бинарные соединения элемента с кислородом, имеющие степень окисления, составляющую -2. Всем известными примерами являются песок, вода, ржавчина, красители, углекислый газ.
Соляная кислота взаимодействует не со всеми соединениями, а лишь с оксидами металлов. Вследствие реакции также образуется растворимая соль и вода. В качестве примера можно привести процесс, происходящий между кислотой и оксидом магния, щелочноземельного металла: MgO + 2HCl → MgCl2 + Н2О.
Использование в быту

- Чистим накипь. Заполните электрочайник водой, засыпьте 30-50 грамм кислоты и прокипятите в течение 5 минут. Взболтайте жидкость внутри чайника и вылейте. Может проводиться несколько раз до тех пор, пока результат не будет удовлетворительным. После чистки рекомендуется провести кипячения чистой воды.
- Моем посуду. Чтобы придать посуде блеск и свежесть, приготовьте раствор со следующим содержанием: 5 грамм лимонки на 1 литр воды.
- Чистим сантехнику. Образовавшийся в ванне налет, удаляется при помощи простого рецепта: 200 грамм кислоты заливаем горячей водой (ванна должна быть полной). Оставляем на 8 часов и сливаем. Включив душ, моем всю поверхность при помощи губки.
- Удаляем пятна на одежде. Пятна различного характера удаляются с использованием раствора: 1 чайная ложка на 1 стакан воды. Проблемное место погружается в жидкость на 2-3 минуты, после чего застирывается в теплой воде с применением стирального порошка.
- Поливаем растения. Лимонная кислота используется в качестве обеззараживающего, антибактериального и иммуностимулирующего средства для растений. Для этого приготовьте раствор: 1 чайная ложка кислоты на 5 литров воды. Поливать не чаще 1 раза в месяц.
- Боремся с домашними насекомыми. В данном случае в приготовлении растворов нет необходимости. Достаточно рассыпать порошок в тех местах, где наблюдается массовое скопление муравьев. Для уничтожения тараканов сыпьте порошок в помойное ведро.
Лимонная кислота нашла широкое применение практически во всех сферах нашей жизнедеятельности, став необходимым продуктом для приготовления выпечки, консервации продуктов и изготовления напитков. В быту также немало мест, где применяется лимонная кислота. Проявив немного смекалки и запасшись терпением, можно приготовить этот продукт в домашних условиях.
Использование на производстве
Она имеет широкое применение в металлургической, пищевой и медицинской промышленности.
- Металлургии. Применение при паянии, лужении и зачистке металлов.
- Пищевая промышленность. Применение при производстве пищевых регуляторов кислотности, к примеру, Е507.
- Гальванопластика. Используется при травлении.
- Медицине. Находит свое применение при производстве искусственного желудочного сока.
Входит в состав синтетических красителей. Используется при производстве чистящих и моющих средств. Но в жидкостях, предназначенных для бытового использования, концентрация серной кислоты незначительна.
Как получают
Процесс производства соляной жидкости состоит из этапов получение хлорводорода и абсорбация (поглощение) его водой.
Существует три промышленных способа получения хлористого водорода:
