Как определить ортофосфорную кислоту в домашних условиях?
Ортофосфорная кислота
Формула ортофосфорной кислоты: — H3PO4. Приставка «орто» указывает на то, что кислота кислородная и, что в ней содержится наибольшее число гидроксильных групп.
Меньше всего их в мета-соединениях. Среднее число – в пара — кислотах. У фосфорной есть и мета-, и пара-изомер. Заметим, что все три приставки используют, так же, в названиях органических кислот, к коим ортофосфорная не относится. В органической химии, мета – характеристика для заместителей структурного кольца, стоящих через один атом. В пара-соединениях заместители максимально удалены, а в орто – соседи.
Внешне ортофосфорная кислота – кристаллы ромбической формы. Они бесцветны и плавятся при 42 градусах Цельсия. Однако, из-за хорошей растворимости вещества в воде, химики чаще имеют дело с полугидратомкислоты. Его формула: — H3PO4*0,5 H2O.
Если кристаллизовать полугидрат, получатся гексагональные призмы. Увидеть их можно, взяв раствор ортофосфорной кислоты и охладив его. Выпадет осадок. Это и есть полугидрат. Его температура плавления на 13 градусов меньше, чем у чистой кислоты. С водой кислота смешивается в любых соотношениях. Причина кроется в системе связей с жидкостью. Молекулы кислоты охотно стыкуются с ней, отсоединяясь, при этом, друг от друга. То есть, в воде соединение распадается на массу отдельных фрагментов, создавших водородные связи со структурными элементами жидкости.
Если же рассматривать строение чистой ортофосфорной кислоты, то она представляет макромолекулу. Отдельные молекулы в ней связаны между собой. Водородные связи прочны и надежны. Это сказывается на физических свойствах.
Монолит плохо проводит электричество, почти не способен к диффузии, то есть, проникновению в другие вещества.
Если чистая ортофосфорная кислота плавится, то жидкость получается вязкой и маслянистой, — молекулы соединения не хотят отпускать друг друга. В растворе кислота может быть электролитом средней силы. Дойти до высшей отметки не дает внутреннее строение молекул ортофосфорного соединения. Длины связей между атомами в нем нетипичны. Согласно формуле, между фосфором и кислородом образуется двойная стыковка. Но, высчитывая длину связи, получаем 1,74, то есть, число, не кратное двум. Длина одинарной связи между кислородом и водородом, напротив, больше положенного, — 1,3 вместо 1-го. Получается, электронная плотность связи P=O частично распределяется по другим связям.
Отсутствие резкого различия в длинах связей приводит к нестандартному строению молекул. Их форма приближена к тетраэдрам, то есть, пирамидальна. Вследствие такого строения реакция ортофосфорной кислоты с большинством веществ невозможна, протекает медленно.
В химическом плане кислота пассивна, в отличии от серной и соляной кислот, с резким различием в длинах внутримолекулярных связей.
Из возможных химических реакций, определяющей для ортофосфорного соединения является взаимодействие с нитратом серебра. Выпадает желтый осадок
Добыча ортофосфорной кислоты
Ортофосфорную к ислоту получают из фосфатов. Это эфиры и соли фосфорных кислот. Иногда используют ортофосфат калия с формулой K3PO4. но, чаще, берут конденсированные фосфаты. В них больше одного атома фосфора. Фосфаты, в свою очередь, добывают из фосфоритов. Это природное сырье, а точнее, группа минералов. Используют наиболее распространенные. Их два. Один – апатит, а второй фосфорит, в честь которого и названа группа камней.
Пример получения кислоты из соединении фосфата кальция и сульфата водорода. Запись реакции такова: — Ca3(PO4)2 + 3H2SO4 à 3CaSO4 + 2H3PO4.
Кроме фосфатов, в ход идет и пентохлорид фосфора. Его, так же, называют хлорангидридом фосфорной кислоты.
Для получения последней, достаточно гидролиза, то есть, взаимодействия с водой. Реакция такова: — PCL5 + 4H2O à H3PO4 + 5HCl.
Взаимодействовать с водой заставляют, так же, оксид фосфора. Его получают, сжигая 15-ый элемент в присутствии кислорода.
Взаимодействие оксида с водой дает две молекулы орто-кислоты, а значит, эта реакция наиболее выгодна, не имеет побочных продуктов. Убедимся, глядя на химическую запись процесса: — P2O5 + 3H2O à 2H3PO4.
Отметим, что с водой оксид фосфора реагирует бурно. Дабы слегка «усмирить» выброс тепла, бурление, исходное сырье обрабатывают концентрированным раствором уже полученной кислоты. Концентрат необходимо нагреть до 200-от градусов Цельсия.
Применение ортофосфорной кислоты
Удаление ортофосфорной кислоты из жизни человека может вызвать коллапс. Соединение используется, как минимум, в семи сферах промышленности.
В пищевой отрасли кислоту называют Е338. Обработка ортофосфорной кислотой продуктов фиксирует их цвет, не позволяет изменить его. Во многом, это вызвано тем, что добавка приостанавливает процессы окисления.
Е338 относится к антиоксидантам, в отличие от многих ешек, полезна, как и сам фосфор. В организме он входит в фосфотазы.
Это ферменты, без коих клетки не смогут нормально функционировать. Нормальный вкус без Е338 тоже получается не всегда.
Добавка придает блюдам приятные кислинку, или остроту. Конкретный вкус зависит от количества кислоты в продукте и ее концентрации.
Ортофосфорная кислота с металлами реагирует, как и большинство кислот.
Именно поэтому, за длительный срок, соединение может растворить гвоздь и, именно поэтому, используется в очищающих смесях для снятия ржавчины, полировки металлических поверхностей.
Ортофосфорная кислота от ржавчины чаще всего используется в быту, при реставрации предметов.
При этом, реагент используют и на крупном производстве. Металлурги делают на основе ортофосфорного соединения флюсы.
Они облегчают отделение от руды пустой породы и снижают температуру плавления. Соответственно, флюсы нужны при пайке.
Ортофосфорная кислота в аптеке. Вещество входит в состав средств от мочекаменной болезни.
К тому же, героиню статьи используют стоматологи. Им реактив нужен для протравки эмали перед пломбированием, а так же, обработки внутренней части коронок.
Кислота частично растворяет металлическую основу протезов. В ней появляются поры, в которые попадает скрепляющий цемент. В итоге, соединение коронки с зубом получается максимально прочным.
Ортофосфорная кислота входит в состав фреонов, а они, как известно, — основа морозильных установок.
Основой героиня статьи является и для многих косметических средств. В них кислота стабилизирует химические связи между составными элементами.
Аналогичную функцию соединение выполняет в моющих средствах из разряда бытовой химии.
Добавим к списку ортофосфорную кислоту в гидрожидкостях для авиационной технике, в удобрениях, даже в молекулярных исследованиях биологов. Последние, используют реагент для осветления срезов тканей, рассматриваемых под микроскопом.
Цена ортофосфорной кислоты
Купить ортофосфорную кислоту, как правило, предлагают в растворах. Основная концентрация – 85%. Разливают в канистры по 25,30, 32, 40 литров.
Стоит учесть, что стоимость зависит от ГОСТа. Ортофосфорная кислота 6552-80 чистая, подходит для пищевой промышленности, реактивов, косметической отрасли.
Но, есть и техническая жидкость. Она желтовата, что указывает на наличие загрязнений. ГОСТ технической кислоты – 10678-76. В рознице ортофосфорную кислоту продают в маленьких тюбиках.
Остальная продукция содержит много дополнительных элементов. В сельскохозяйственных удобрениях, к примеру, кроме ортофосфорной кислоты присутствует комплекс других минералов.
Поэтому, об объективной стоимости ортофосфорного соединения судят лишь по объявлениям об оптовых закупках концентрированного раствора реагента.
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Ортофосфорная кислота
- Получение ортофосфорной кислоты
- Способ, основанный на применении высоких температур
- Производство смеси под воздействием кислот неорганического типа
- Очищение и концентрация
- Правила безопасности при работе c фосфорной кислотой
- Правила хранения и перевозки средства
- Вред для организма
- Область использования H3PO4
- Применение в медицине
- Удаление ржавчины
- Механизм обработки металла фосфорным реагентом
- Преобразователь ржавчины
- Применение ортофосфорной основы в быту
- Применение в пищевом производстве
- Правила разведения ортофосфорной кислоты
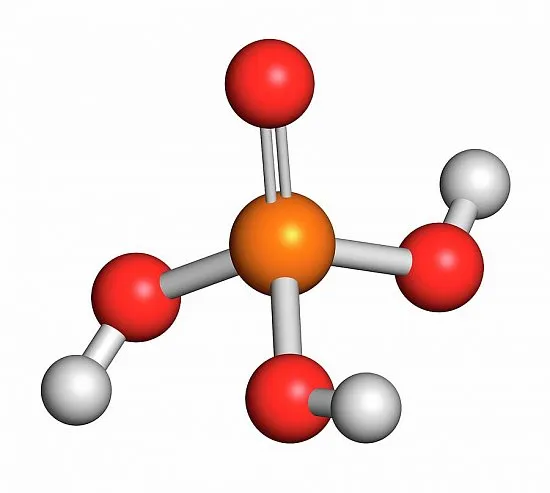
Ортофосфорная кислота относится к категории неорганического типа средней силы, формула комбинации – H3PO4. При стандартных показателях температурного режима и давления реактив выглядит как очень маленькие кристаллы, не имеющие цвета и запаха.
При средней температуре воздуха дегидрат выглядит как кристаллы в форме ромба микро размера. Второе название продукта — фосфорная, внешне выглядит как 85 % прозрачная жидкость без запаха. Кристаллы полностью разлагается при смешивании с растворителями.
Уравнение диссоциации H3PO4 = 3H(+) + PO4(3-). Дегидрат состоит из трех атомов, поэтому разложение занимает три этапа. Молярная масса химической комбинации составляет 98 грамм на 1 моль. Молекулярная масса равняется значению 98.
Дегидрат имеет следующие основные характеристики:
- при смешивании с химическими индикаторами цвет изделия изменяется на красный;
- при большой температуре образует пирофосфорную комбинацию;
- в воде распадаются кристаллы в три стандартных этапа;
- при соединении с производными сильного уровня, образует многогранные соли;
- в сочетании с серебром, вещество выделяет незначительный осадок желтого цвета.
Получение ортофосфорной кислоты
Впервые наука узнала о продукте от ученого Бойля, который выявил формулу во время химических опытов. Основа для выжимки субстанции — фосфорный оксид. Роберт брал для работы специальные лабораторные инструменты, реактивы фосфора и азот. Выделение материи состоит в окислении основы. В производстве есть несколько методик выделения реагента:
Способ, основанный на применении высоких температур
В основе методики лежит термическая обработка до достижения реакции выделившегося оксида с водным раствором. Технологическая генерация разная, но в результате получается одна материя.
Первый вид основан на совместном взаимодействии обоих реактивов в одной емкости. В сосуд под высоким давлением подают фосфор, который разлагается под действием высокого температурного режима. Субстанция многофункционален: она окислитель оксида, защита поверхности емкости от огня, отвод части тепла из реакции. Применяемая колонна выполнена из стали, выдерживающий негативное воздействие реагента при температуре до 100 градусов. Полученная данным образом смесь практически не содержит в составе фосфор, но при этом содержит в небольшом количестве мышьяк. Жидкость очищают специальными химикатами, с дальнейшей фильтрацией смеси.
В основе второй методики лежит раздельная обработка реактивов. Для процедуры разложения применяют первую камеру, для насыщения массы второй сосуд. Используемые контейнеры имеют высокую защиту от негативных последствий дегидрата, что позволяет сохранить целостность стенок и увеличить срок эксплуатации предмета.
Производство смеси под воздействием кислот неорганического типа
С 80-ых годов ученые добывают фосфорное соединение на основе серы, вступающей в реакцию с фосфитами. Большую популярность метод получил в сельском хозяйстве, благодаря спросу на удобрения для насыщения почвы питательными веществами. Описанный способ является основным видом выделения химиката, за счет минимального расхода энергии. Ученые применяют два способа выделения формулы по отдельности или совмещая методики для эффективного результата.
Стандартный метод получения химиката заключается в принципе давления на вещество при низких температурах, что исключает риск коррозии. Описанный способ подходит для обработки сырья в большом объеме. Предварительным этапом выступает размельчение массы на мелкие частицы. Затем в реактор поступает фосфат и отдельно серная кислота. Температурный режим поддерживают в оптимальном значении в 80 градусов. За счет предварительного размельчения сырья и концентрирования полученной смеси, время выделения дегидрата увеличивается. Преимуществом второго этапа, используемого для выделения комбинации, является отсутствие этапа проведения процедуры концентрирования. Процесс обработки осуществляется при оптимальной температуре в 100 градусов. Степень концентрации полученной смеси достигает 48%.
Совмещение двух процессов изобрели японские ученые. Методика позволяет добывать гипс, который находится в дефициты в стране, из-за отсутствия естественных залежей сырья.
Очищение и концентрация
Правила безопасности при работе c фосфорной кислотой
При взаимодействии с формулой следует придерживаться рекомендаций специалистов, с целью обеспечения безопасности для здоровья человека и окружающей среды. Важно исключить прямое взаимодействие с органами дыхания, зрения, кожными покровами.
Правила использования средства:
- при обработке жидкостью в помещении, должен быть о хороший уровень вентиляции;
- для защиты кожных покровов и органов дыхания, зрения необходимо использовать: резиновые перчатки, респираторные маски и защитные очки;
- открытые участки кожных покровов нужно закрыть, что позволит избежать ожогов при попадании средства на человека;
- в случае соприкосновения средства с кожей следует промыть обожженную зону чистой водой, наложить свободную марлевую повязку и обратиться за медицинской консультацией в больницу.
Правила хранения и перевозки средства
Для хранения смеси рекомендовано использовать сосуды, выполненные из стекла, полимера или стали, стойкой к появлению ржавчины. Место, где будет размещаться бутылка, следует защитить от прямого попадания солнечного света. Помещение должно быть сухим, чтобы исключить конденсат. Рекомендуется поддерживать комнатную температуру хранения, исключив резкие перепады значений. Срок хранения содержимого бутылки, при условии соблюдения всех рекомендаций, составляет 12 месяцев.
Транспортировка реагента производится в автомобильном транспорте, оборудованном емкостями из металла. Свойства цистерны не изменяются при попадании химических составляющих. Перевозить товар можно водным видом транспорта, с учетом соблюдения рекомендаций по безопасности, в плотно закрытых бочках. Гидроксид относят к категории опасных веществ, поэтому при перевозке груза на большие расстояния нужно оформить сопроводительную документацию.
Вред для организма  » >
» >
Область использования H3PO4
В современном мире часто применяют одну химическую формулу в решения задач в разных областях науки, быта и медицины. Гидроксид фосфора востребован в разных вариантах эксплуатации. Продукт использует при необходимости создания солей кальция и алюминия, используя рецепт органического синтеза. В сфере промышленности дегидрат незаменим при обработке детали, позволяющей защитить верхний слой от разрушительных последствий ржавчины. Смесь не только удаляет образовавшийся дефект, но и защищает конструкцию от повторного появления коррозии. Бытовая химия, используемая для ухода за домом, в своем составе имеет фосфорную основу.
Кристаллы фосфора востребованы и в других сферах:
- нефтяное производство;
- производство спичечных изделий;
- изготовление пленки, необходимой для записи видео формата;
- для изготовления предметов, имеющих оптимальные показатели стойкости к воздействию высоких температур;
- в качестве составляющей средств для мытья поверхности;
- в автомобильной промышленности. Применение вещества позволяет убрать дефект машины, не нарушая целостность поверхности.
В сельском хозяйстве продукт нужен для питания растений, что приводит к быстрому росту урожая. Сельские культуры, благодаря фосфору, получают высокую стойкость к низкому температурному режиму и негативным природным условиям. Почва насыщается полезными частицами, что положительно сказывается на ее плодородность. Для некоторых видов животных необходимо наличие соединений фосфора, позволяющих обеспечить нормальное развитие метаболизма организма. Свойства продукта помогают в формировании панциря у черепахи, наростов у некоторых представителей животного мира. Ортофосфорный элемент в пищевой промышленности используется под буквенным кодом Е в комбинации с числовым кодом 338. Добавку можно встретить в следующих продуктах питания: колбаса, газированные напитки.
Применение в медицине
Удаление ржавчины
Элемент используют как в быту для разового удаления ржавчины, так и в массовых масштабах промышленности. Рекомендовано соблюдать рекомендованные правила безопасности при работе с реагентом данного типа.
Главным преимуществом комбинации выступает двойное действие на основание:
- удаление масс, изменивших свои свойства, под действием ржавчины;
- создание пленки, защищающей деталь от дальнейшего развития и образования нового дефекта.
Внешнее покрытие образуется вследствие разложения оксида слоя металла, при диссоциации продукта, заменяемым фосфорным соединением. Отзывы людей, опробовавших лично данный метод устранения изъяна, свидетельствуют об образовании пленки серого цвета, после воздействия дегидрата на металл. Образовавшийся налет имеет на ощупь маслянистую текстуру. Очищение металлической плоскости производится следующими эффективными способами:
- погружение целого предмета из металла в сосуд с раствором;
- нанесение жидкости только на зону дефекта при помощи бутылки с пульверизатором или широкой кисти;
- нанесение на металл осуществляется, после выполнения ручной чистки плоскости, необходимой для устранения разрушенных частиц.
В процессе выбора способа нанесения подготовленных к применению гранул нужно учитывать индивидуальные особенности обрабатываемого предмета и условий места осуществления процесса.
Механизм обработки металла фосфорным реагентом
Полное погружение выбранной позиции в реагент
Нанесения жидкости при помощи использования кисти или пульверизатора
Преобразователь ржавчины
Применение ортофосфорной основы в быту
В быту раствор применяется в составе химических средств, используемых для очищения поверхности. Реагент хорошо очищает унитазы и санузлы, устраняет ржавчину. Не рекомендуется применять данные средства для очищения поверхности для ванн и унитазов, выполненных из акрила. Реагент рекомендуется применять для мытья поверхностей, изготовленных из фаянса и эмали.
Для удаления ржавчины с основания ванн и умывальников необходимо предварительно произвести обезжиривание основания. После удаления жиров с поверхности следует нанести жидкость на дефект основания. Для приготовления смеси нужно взять 1 литр воды и основного средства в объеме 200 гр. В зависимости от степени загрязнения конструкции, время воздействия реагента составляет от 60 минут до 12 часов. В завершение процедуры нужно тщательно смыть состав раствором соды и проточной воды. Санузел обрабатывают смесью из соды, нейтрализующей остаток средства, далее устраняют остатки слоя химиката чистой водой. Преимуществом технологии является сохранение целостности поверхности предмета, так как проведения механической чистки не требуется.
Ортофосфорная кислота — применение
Ортофосфорная кислота — универсальное вещество, которое применяется во многих сферах деятельности. Чаще всего ее используют для удаления ржавчины с металлических поверхностей.
Что такое ортофосфорная кислота
Что же такое ортофосфорная (фосфорная) кислота? Она относится к неорганическим веществам. При комнатной температуре она приобретает вид ромбических кристаллов. Имеет консистенцию сиропа и представляет собой 85-процентный раствор. Ее кристаллы хорошо растворимы в воде и этиловом спирте.
Это вещество относится к группе антиоксидантов (антиокислителей) и используется как регулятор кислотности. В качестве добавки ей присвоен код Е338.

Описание препарата, характеристики, вредные свойства
Химическая формула вещества — H3PO4. При нагревании вещества до температуры более 213°C оно меняет свой состав и превращается в пирофосфорную кислоту (H4P2O7).
Основным свойством этого химического компонента выступает отсутствие выраженного запаха и цвета. Она обладает хорошей растворимостью в воде и других жидкостях. Образуется она при химическом воздействии на фосфат или же во время применения гидролиза. Ее преимуществом выступает низкая себестоимость (в отличие от лимонной кислоты). В связи с этим ее часто используют в производстве напитков и продуктов питания.
Это вещество негативно влияет на здоровье, повышая кислотность желудочного сока. Людям, страдающим гастритом с повышенной кислотностью, необходимо свести к минимуму или исключить из рациона продукты, содержащие в своем составе такое вещество.
Помимо всего прочего, она способствует выведению из организма кальция, что может негативно сказаться на состоянии зубов и костей. Передозировка этого вещества может спровоцировать нарушения в работе ЖКТ, вызвать тошноту и рвоту.
Получение кислоты
Многие задаются вопросом, как получить кислоту в лабораторных условиях? Существуют различные способы получения ортофосфорной кислоты, наиболее распространенными среди которых являются следующие:
- При взаимодействии воды с оксидом фосфора (v) во время нагревания:
P2O5 + 3H2O = 2H3PO4
- При воздействии серной кислоты на ортофосфат кальция (природную соль):
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
- При воздействии на фосфор азотной кислоты высокой концентрации:
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO

Сфера применения
Ортофосфорную кислоту применяют в таких сферах деятельности, как нефтяная промышленность, стоматология, животноводство. Ее также используют при производстве:
- спичек;
- кинопленки;
- фосфатных удобрений;
- средств бытовой химии;
- веществ против коррозии металла;
- огнеупорных элементов и материалов.
Правила работы с кислотой
Работа с ортофосфорной кислотой должна происходить в помещении с хорошей вентиляцией. Следует обязательно надеть респиратор для предотвращения попадания едких паров в дыхательные пути и очки для защиты глаз. Если нет под рукой этих защитных средств, то следует воспользоваться маской. Обязательно следует надевать перчатки и защищать открытую поверхность кожи от попадания на нее вещества, т. к. это может привести к ожогам. При попадании ее на кожные покровы следует тщательно промыть их под проточной водой, после чего обратиться за медицинской помощью.
Перевозка реагента должна осуществляться в специальном транспорте, оборудованном железными цистернами, не поддающимися ее разрушительному влиянию. Ее можно перевозить и при помощи других транспортных средств, как сухопутных, так и водных. Но при этом должны быть соблюдены все правила техники безопасности.
Хранить ее следует в месте, защищенном от прямого попадания солнечных лучей. Срок хранения при таких условиях составляет не больше 1 года.
Использование кислоты
Применение фосфорной кислоты достаточно широкое. Стоит рассмотреть наиболее популярные методы ее использования.

В медицине
Ее применяют в стоматологии во время пломбирования зубов для протравливания эмали непосредственно перед началом процесса. Эта процедура имеет свои негативные стороны, т. к. контролировать глубину и стадию расщепления эмали невозможно, как и их полное удаление перед пломбированием. Оставшееся после такой процедуры вещество может уменьшить прочность защиты и привести к образованию кислотных остатков на эмали зуба. Эта кислота добавляется в малых дозах в зубные отбеливатели.
Удаление ржавчины с поверхности металла погружным методом и поверхностным нанесением. Преобразователь ржавчины
Преимущество удаления ржавчины ортофосфорной кислотой состоит в том, что она убирает коррозию с металла и создает тонкую пленку на них, защищая от разных внешних воздействий. После покрытия этим веществом металлической поверхности начинается активный процесс разъедания и поглощения оксида железа. Затем на плоскости металла образуется серая пленка маслянистой консистенции.
Существуют различные методы удаления окислов, среди которых можно выделить следующие:
- с полным опусканием элемента в кислотный раствор;
- поверхностная обработка с использованием распылителя, кисти или валика;
- покрытие раствором предварительно обработанного механическим способом верхнего слоя металла.
Преобразователь коррозии — это кислотный раствор с различными добавками. Существуют такие виды растворов, в зависимости от используемых в их составе добавок:
- грунтовки;
- модификаторы-стабилизаторы;
- преобразователи ржавчины.
К 1 типу относится грунтовка ЭВА-0112, состоящая из основного компонента и 85% раствора вещества. Она выступает основой под покраску.
В состав преобразователя «Цинкарь» входит кислота и соли марганца и цинка. При его применении ржавчина трансформируется в плотный защитный слой. Происходит процесс легирования.

Ортофосфорная кислота для металла
Для очистки или для пайки металлических элементов необходимо проделать следующие операции. Перед полным погружением металлического элемента в ортофосфорный состав, его вначале зачищают от разных видов налета на поверхности, в частности от жиров. Для этого следует промыть деталь с использованием чистящего средства. После этого необходимо растворить 150 мл вещества в 1 л воды и опустить в этот раствор металлический элемент на 1 час, время от времени размешивая жидкость для большей эффективности.
Затем необходимо смыть смесь раствором, который состоит из 50% воды, 2% нашатырного спирта и 48% этанола. После этого элемент нужно ополоснуть под струей водой и хорошо высушить.
Перед тем как нанести распылитель на поверхность валиком или кистью, следует предварительно зачистить поверхность от ржавчины. После нанесения следует немного подождать, а затем смыть смесь нейтрализующим раствором и высушить деталь.
Такие процедуры можно проводить с разными металлами, в т. ч. и алюминием.
Применение в сельском хозяйстве
В сельском хозяйстве используют фосфорную кислоту, добытую из руды, в качестве удобрения. При попадании в грунт, а затем в растения, она помогает им перенести засуху и морозы. При этом почва становится более плодородной и благоприятной для выращивания овощных культур и зелени.
Применение кислоты в быту и пищевой промышленности
Применение кислоты в быту подразумевает ее использование для удаления коррозии с различных поверхностей (за исключением акриловых). Он подходит для обработки эмалированных и фаянсовых поверхностей. Перед нанесением раствора ортофосфорной кислоты металлическую поверхность необходимо обработать моющим средством. Для приготовления раствора следует смешать 1 л воды и 200 г действующего вещества, а затем нанести смесь на обрабатываемую плоскость на 1-12 часов. По прошествии времени смесь необходимо погасить содовым раствором и смыть.
В пищевом производстве применяется как регулятор кислотности.
Техника безопасности при работе с кислотой
Во время работы с этим химическим элементом нужно соблюдать меры безопасности, т. к. она представляет угрозу для здоровья человека. В помещении должна быть хорошая вентиляция. Спровоцировать пожар или взрыв. Перед тем как начать работать, нужно одеть респиратор, перчатки и очки, а также спецодежду и обувь.
При попадании жидкости на слизистые оболочки и кожные покровы может возникнуть головокружение, кашель, рвота, химический ожог. В таком случае следует вызвать врача, промыть пораженный участок, сделать свободную повязку и осуществить нейтрализацию фосфорной кислоты щелочью.

Как правильно хранить и перевозить кислоту
При хранении и транспортировке кислоты следует соблюдать необходимые условия. Хранить ее разрешено только в специальных емкостях:
- стеклянных;
- полимерных сосудах;
- сосудах из нержавеющей стали.
Фосфорная кислота — агрессивное вещество, в связи с чем порошок следует содержать в изолированной таре. В кислоту не должно попадать инородных веществ. Тара для перевозки и хранения должна быть сухой и чистой.
Чтобы раствор имел нужные свойства, следует соблюдать все условия. При некачественном составе возможно выделение токсичных паров. Помимо всего прочего, такой раствор не сможет защитить поверхность металла от негативного влияния окружающих факторов.
Наиболее подходящее для хранения место — сухое и теплое. Не подойдут для этой цели сырые места, в которых образуется большое количество конденсата. Нежелательно пересыпать порошкообразное средство в другие емкости. Лучше всего хранить его в первоначальной упаковке.
Т. к. это вещество принадлежит к разряду опасных, то при его перевозке на дальние расстояния требуется заполнение сопроводительной документации.
Срок хранения фосфорной кислоты составляет 1 год с момента изготовления.
Температура замерзания 85% раствора составляет — 21°С. Температура плавления + 42°С.
Читайте также:

Пятна, полученные от жира, — это самые распространенные загрязнения, которые оказываются на нашей одежде. «Получить»…

Качество постельного белья сводится по сути к двум показателям — ткани, из которой оно сделано,…

Как чистят семечки на производстве, зависит от того, какие семена требуется избавить от несъедобной части.…
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.

Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.

При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.

Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.) .
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая) .
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , фосфорная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например , фосфорная кислота взаимодействует с гидрокарбонатом натрия:
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , фосфорная кислота реагирует с магнием:
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:

Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Аквариум
… PRO рыб
О регуляции жёсткости и pH. Редокспотенциал

Если аквариумист собирается выращивать растения, нуждающиеся в воде, жесткость которой должна отличаться от жесткости той, которая имеется в его распоряжении, жесткость воды можно изменить. Для этого существуют различные способы.
Повышение жёсткости воды
Повысить жесткость воды можно добавляя в аквариум кусочки мрамора или других известняковых пород. Добавленная в грунт мраморная крошка, медленно растворяясь, повышает жесткость очень мягкой воды на 2 – 4°. Однако контролировать уровень жесткости в этом случае очень трудно. Можно применить фильтрование аквариумной воды через слой мраморной крошки. Меняя количество воды, пропускаемой через фильтр, можно влиять на уровень общей жесткости воды в аквариуме.
Самым надежным способом повышения жесткости можно считать добавление в воду хлористого кальция и сернокислого магния. В аквариум можно добавлять 10%-ный раствор хлористого кальция, продающийся в аптеках. Для создания близкого к природному соотношения ионов кальция и магния в воду также следует добавлять раствор сульфата магния. Приготовить его можно в домашних условиях. Для этого 50 г сухого вещества сульфата магния, который еще называется горькой, или английской солью, растворяют, доводя общий объем раствора до 750 мл. Получается раствор с концентрацией около 6,7%. Пользоваться таким раствором очень удобно, так как он доливается в воду в том же объеме, что и 10-процентный раствор хлористого кальция. При внесении на 1 л воды по 1 мл каждого раствора жесткость повышается примерно на 4°. Исходя из этой простой пропорции и зная начальную жесткость воды, очень легко повысить жесткость до желаемой величины.
Понижение жёсткости воды
Совсем иначе обстоит дело со снижением жесткости. Надежным способом удаления солей из воды можно считать только дистилляцию, или выпаривание. В домашних условиях сделать это довольно трудно, да и применение очень мягкой воды крайне ограничено, так что любителю аквариумных растений нет необходимости доставать дистиллированную воду.
В тех редких случаях, когда необходимо получить воду с точно заданными параметрами, в частности жесткостью, следует за основу взять дистиллированную воду и смешать ее с водой известной жесткости. Можно также внести в воду необходимое количество хлористого кальция или сернокислого магния.
Существуют способы умягчения воды, достаточно простые и вполне пригодные для использования аквариумистом, серьезно занимающимся выращиванием водных растений.
Начнем с того, что воду можно просто кипятить. Затем воду остужают не перемешивая. После этого осторожно сливают только верхние 2/3 объема, так как в придонном слое скапливаются соли кальция, выпадающие в осадок при большой концентрации. Слитая с поверхности вода значительно мягче исходной.
Менее эффективным способом умягчения воды является добавление отвара ольховых шишек или экстракта торфа. Жесткость воды уменьшается незначительно, а кроме того меняется ее химический состав. Это может повлиять на рост некоторых растений. Такой способ смягчения больше всего подходит для стимуляции нереста некоторых харацинид.
В литературе по акваристике рекомендуется применять такие вещества, как трилон-Б (натриевая соль этилендиаминтетрауксусной кислоты) и ЭДТА (этилендиаминтетрауксусная кислота), для образования комплексных соединений металлов, в частности кальция и магния, т. е. для умягчения воды. Дело в том, что многие металлы могут усваиваться растениями из воды только в виде сложных соединений. Рекомендуемая концентрация трилона-Б, вещества, более доступного аквариумистам,– около 25 мг на 1 л воды. Такое количество трилона не меняет жесткость воды. Количество этого вещества, необходимое для умягчения воды жесткой или средней жесткости, колеблется в пределах 1 – 2 г на 1 л. Опыты показали, что добавление трилона в количестве 1 – 1,5 г в воду жесткостью 12 – 16° позволяет выращивать растения, требующие очень мягкой воды.
Кроме жесткости очень важным показателем физико-химического состояния воды является активная реакция, или рН. Этот показатель определяется количеством содержащихся в воде водородных (Н+ и гидроксильных (ОН-) ионов. Нейтральная вода имеет показатель рН равный 7. Значение рН меньше 6,8 означает, что вода обладает кислой реакцией. При рН больше 7,2 вода становится щелочной. Оптимальные условия для большинства растений складываются при значениях рН от 6 до 8, но это очень приблизительно.
Показатель рН природной воды может колебаться в широких пределах. Отстоянная в течение суток вода без дополнительных добавок имеет реакцию, близкую к нейтральной. В практике нейтральной считается рода с рН 6,8 – 7,2.
Вода в аквариуме может менять свои показатели, становясь более кислой или более щелочной, под воздействием живых организмов.
Иногда аквариумисту нужно изменить показатель активней реакции воды. Для этого в воду добавляется кислота или щелочь. Далеко не все кислоты и щелочи подходят для изменения рН в аквариуме, так как многие из них оказывают токсическое воздействие на живые организмы.
Подкисление воды
Для подкисления воды аквариума из минеральных кислот пригодна только ортофосфорная кислота. Попытки использовать соляную, серную, уксусную кислоты, наиболее широко распространенные, могут вызвать нарушение обмена веществ у растений и рыб. Ортофосфорную кислоту можно использовать только в растворе и добавлять в аквариум каплями, обязательно контролируя изменения рН.
Более простой способ подкисления воды заключается в добавлении к ней экстракта торфа или отвара ольховых шишек. Столовая ложка ольховых шишек заливается стаканом кипятка и кипятится еще 5 – 7 минут. Стакан отвара рассчитан на 5 – 10 л воды.
К подкислению воды следует прибегать только в тех случаях, когда нужно создать определенные условия для рыб. При содержании растений такой необходимости обычно не возникает. В аквариумной воде постепенно накапливаются органические соединения, она со временем приобретает кислую реакцию. Такая вода называется старой.
Ощелачивание воды
Значительно чаще, чем подкислением, любителю аквариумных растений приходится заниматься ощелачиванием воды. Это происходит потому, что, как уже говорилось, в аквариуме накапливаются органические кислоты, снижающие рН, а для очень многих растений больше подходит слабощелочная вода.
Для ощелачивания воды подходит любая щелочь. При использовании едкого натрия или едкого калия, которые следует применять только в растворе и пользоваться которыми необходимо с большой осторожностью, сдвиг рН в сторону ощелачивания в аквариуме происходит очень резко и сохраняется лишь несколько часов из-за активного воздействия водных организмов.
Единственным надежным способом ощелачивания воды, гарантирующим стабильность показателей, можно считать добавление в аквариум питьевой соды в дозе 0,2–0,5 г на 1 л воды. Питьевая сода, или гидрокарбонат натрия, обладает замечательными свойствами. Это соединение ведет себя в растворе как слабая щелочь, но при этом с сильными щелочами реагирует как кислота. Именно в этом выражаются ее буферные свойства. Даже при некоторой передозировке питьевой соды рН воды не поднимается выше 8,4. При этом следует отметить, что подъем рН до 9 практически не ухудшает самочувствия рыб и растений.
Ощелачивание питьевой содой мягкой и очень мягкой воды не дает стойкого результата. Если увеличить концентрацию соды в воде аквариума, повышенное содержание натрия оказывает токсическое воздействие на растения.
Единственно верный способ получить воду со стойкой щелочной реакцией – повысить ее жесткость не менее чем до 8° и добавить к ней питьевую соду. Следует отметить, что в аквариумах с часто подмениваемой жесткой водой рН обычно больше 7. Для придания буферных свойств такой воде питьевую соду можно добавлять лишь в очень малом количестве. Такая вода имеет незначительные колебания рН в течение суток и не приобретает кислую реакцию при старении.
Как уже говорилось, значительные добавки соды могут привести к избытку натрия в воде. Для рыб такой избыток чаще всего бывает безвредным, а для растений он может стать губительным. Аквариумисты, содержащие «живородок», иногда добавляют в воду обычную поваренную соль. В таких аквариумах редко можно наблюдать хороший рост растений. (Правда, это относится только к редким, весьма требовательным видам.) Подсаливание воды для живородящих карпозубых необязательно. Более правильным при содержании этих рыб является повышение жесткости воды в сочетании с малыми добавками питьевой соды.
Незначительный избыток натрия в воде можно компенсировать добавками солей калия. Лучший результат получается при добавлении в воду поташа – углекислого калия (К2СО3). Соотношение ионов натрия и калия в воде 5:1 или 4:1 прекрасно переносится растениями и рыбами, но избыток калия губителен для рыб. Поэтому вносить такие химические элементы, как натрий и калий, необходимые для жизнедеятельности организмов, нужно очень осторожно.
Можно рекомендовать аквариумистам приготовить смесь питьевой соды и поташа в весовом соотношении 4:1 и добавлять ее в количестве от половины до целой чайной ложки на 10 л подмениваемой воды.
Редокспотенциал
Окислительно-восстановительный потенциал, или редокспотенциал – своеобразный показатель химической и биологической активности воды и грунта. Определить его можно только с помощью электронного прибора – рН-метра. Сделать это в домашних условиях, как правило, нет возможности, но иметь представление о редокспотенциале аквариумисту-любителю совершенно необходимо. Дело в том, что существование гидрофитов возможно только в очень ограниченном диапазоне этого показателя состояния воды. Редокспотенциал измеряется в условных единицах от 0 до 42 и имеет следующие значения:
| 40 – 42 | полностью окисленная среда |
| 35 – 39 | сильно окисленная |
| 30 – 34 | умеренно окисленная |
| 24 – 29 | слабо окисленная |
| 18 – 23 | слабо восстановленная |
| 12 – 17 | умеренно восстановленная |
| 6 – 11 | сильно восстановленная |
| 0 – 5 | полностью восстановленная |
Аквариумные растения могут существовать при значениях редокспотенциала от 27 до 35.
В новом аквариуме редокспотенциал имеет значения, близкие к 32. В дальнейшем, по мере накопления органических неокисленных веществ, величина его начинает снижаться. Аквариумист может наблюдать, как в новом аквариуме начинают прекрасно расти многие мелколистные плавающие в толще воды растения – это показатель высокого редокспотенциала. Потом наступает период развития апоногетонов и эхинодорусов – признак снижения редокспотенциала до 30 – 29. Затем к ним присоединяются криптокорины, значит, редокспотенциал снизился примерно до 28. И вот уже идет деградация эхинодорусов и других растений, а криптокорины процветают – это признак снижения окислительно-восстановительного потенциала до значения, близкого к 27. Если редокспотенциал опускается ниже этой величины, прекращается рост практически всех растений. Но уже ухудшение роста эхинодорусов является четким признаком того, что из аквариума необходимо удалить избыток органики.
Каким способом чистить аквариум, надо решать исходя из конкретных условий. Можно применять любые виды фильтров: внутренний, наружный с активным наполнителем или без него, биологический, а можно воспользоваться самым простым способом чистки грунта – с помощью воронки.
Упрощенно можно сказать, что редокспотенциал для аквариумиста – показатель степени загрязненности воды органическими веществами.
