Как определить степень окисления железа?
Валентность и степень окисления
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы

Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.

В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.

Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы — с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью — способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное понятие.

Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток — получает знак «+».

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉

Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Степени окисления элементов. Как найти степени окисления?
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
| Элемент | Характерная степень окисления | Исключения |
| H | +1 | Гидриды металлов: LIH -1 |
| F | -1 | F 2 |
| O | -2 | F 2 O +2 ; пероксиды, надпероксиды, озониды |
| Li, Na, K, Rb, Cs, Fr | +1 |   |
| Be, Mg, Ca, Sr, Ba, Ra | +2 |   |
| Al | +3 |   |
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3 ).
Решение . Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х — искомая степень окисления. Составляем простейшее уравнение: х + 3 • (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 • (+1) + х + 4 • (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .
Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3 ) 3 .
Решение . Алгоритм остается неизменным. В состав «молекулы» нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 • (+3) + 3х + 9 • (-2) = 0. Ответ: Al +3 (N +5 O -2 3 ) 3 .
Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4 ) 3- .
Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 • (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5 . Определите степени окисления всех элементов в (NH 4 ) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота — нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую «молекулу», а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1 ) 2 S +6 O 4 -2 .
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Пример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH.
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность — нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую «экзотику» здесь обсуждать не будем);
- степень окисления — формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие «валентность», наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Как определить степень окисления железа?













Последнее обновление
4 апреля 2020г.
Валентность —
— это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления
– это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
фтор высшая степень окисления ноль в простом веществе F2 0
кислород высшая степень окисления +2 во фториде кислорода О +2 F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст.ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.) , в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са 0 , O2 0 , Cl2 0
II. ст.ок. в бинарных c оединениях:
Менее электроотрицательный элемент ставится на первое место. ( Исключения: С -4 Н4 + метан и N -3 H 3 + аммиак)
Нужно помнить, что
— ст.ок. металла всегда положительна
— ст.ок. металлов I , II , III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст.ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст.ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2 +1 О2 -1 , Ba +2 O 2 -1 и др. ; карбиды металлов I и II групп Ag 2 +1 C 2 -1 , Ca +2 C 2 -1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe +2 S2 -1 ). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, — S — S- , тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV , у кислорода и серы II .
III. Степень окисления в основаниях Ме + n (ОН) n равна количеству гидроксогрупп .
1. в гидроксогруппе ст.ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст.ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст.ок. водорода +1, кислорода -2
2. ст.ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
х = +5 (не забудьте знак +)
Можно запомнить , что у кислот с высшей ст.ок. центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н N О3 азотная Н N +5 О3
НС l О4 хлорная Н Cl +7 О4
Н Mn О4 марганцовая Н Mn +7 О4
Останется запомнить:
Н N О2 азотистая Н N +3 О2
НС l О3 хлорноватая Н Cl +5 О3
НС l О2 хлористая Н Cl +3 О2
НС l О хлорноватистая Н Cl +1 О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст.ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH 4 + Cl — : записываем ион N х Н4 +1
Наприме р, определить ст.ок. элементов в гексацианоферрате( III ) калия К3[ Fe ( CN )6]
— у калия +1 : К3 +1 [ Fe ( CN )6], отсюда заряд иона [ Fe ( CN )6] 3-
— у железа +3 (указано в названии) [ Fe +3 ( CN )6] 3- , отсюда ( CN )6 6-
— у одной группы ( CN ) —
— более электроотрицательный азот: у него -3, отсюда ( C х N -3 ) —
ст.ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст.ок. водорода равна +1, кислорода -2
ст.ок. углерода -2 (при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте H3PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
Соединения железа и степени окисления металла
Степень окисления железа является важным химическим параметром, который учитывается при поиске руды, технологии производства металла и формировании сплавов.

Физические и химические свойства железа
- Химический элемент №26 является самым распространенным в Солнечной системе, уступая место только алюминию. По данным исследований, его содержание в ядре Земли составляет 85,5%.
- В чистом виде металл имеет белый цвет со свойственным серебристым оттенком и пластичностью. Он является ферромагнетиком со свойственным реагированием на магнит.
- Для химического элемента характерен полиморфизм, то есть различное структурное строение. Металл имеет свою кристаллическую решетку, которая изменяется под влиянием внешних факторов, например при нагревании.
- В природных условиях повышенная концентрация химического элемента сосредоточена в местах извержения пород. Промышленные месторождения формируются в результате внешних и внутренних процессов, происходящих в земной коре, в процессе разрушения и отложения пород, миграции химического элемента.
Содержание металла в речной воде — приблизительно 2 мг/л, а в морской воде его меньше в 100–1000 раз.
- Химический элемент имеет несколько степеней окисления, определяющих его геохимическую особенность нахождения в определенной среде. В нейтральной форме металл находится в ядре Земли.
- Соединение металла с кислородом является основной формой нахождения в природе. Степени окисления химического элемента характеризуют его месторасположения в верхней части земной коры. В зависимости от состава осадочных образований меняется валентность химического элемента.
- С уменьшением температуры увеличивается содержание элемента в минералах. Металл обладает средней активностью, а основные степени окисления составляют +2, +3. При высоких температурах и повышенной влажности железо подвергается коррозии.

Простые соединения металла
- В зависимости от воздействия внешней среды происходит окисление железа. Например, на воздухе в присутствии влаги металл ржавеет. Под влиянием воды и кислорода образуется гидроокись химического элемента со степенью окисления +3. В природе это соединение находится в минерале лимонит.
- Раскаленная проволока из чистого материала горит в кислороде. При этом образуется оксид металла с валентностью II и III. При температуре 700–900 °C химический элемент реагирует с парами воды с выделением водорода.
- В процессе нагревания химический элемент реагирует с неметаллами: бромом, серой, хлором. При воздействии разбавленных соляной и серной кислот образуются соли металла со степенью окисления +2 и выделяется водород.
- Реакции с кислотами проводятся без доступа воздуха из-за изменения степени окисления железа под влиянием кислорода. Окислительно-восстановительные реакции в концентрированных кислотах происходят при нагревании. При этом железо сразу переходит в катион Fe3+. На холоде под влиянием концентрированной серной и азотной кислоты образуется тонкая пленка, которая предотвращает реакцию.
- Химический элемент вытесняет из растворов другие металлы. Например, если погрузить в раствор медного купороса железный гвоздь, то он постепенно покроется чистой медью.
- Под воздействием концентрированных щелочей при нагревании химический элемент проявляет амфотерность, способность проявлять основные и кислотные свойства.
Практическое применение химических параметров материала
В естественных условиях образуются окисды железа. Ценный компонент извлекают из руды путем ее обогащения с использованием различных методов. Технический материал представляет собой сплавы, содержащие примеси и лигатурные добавки:
- углерод;
- серу;
- свинец;
- марганец;
- никель;
- хром;
- кремний.
Их присутствие придает составам новые свойства, устойчивость к воздействию внешней среды, твердость, ковкость.
Для производства чугуна — сплава железа с углеродом, применяют доменный процесс производства, который включает такие стадии:
- обжиг карбонатных и сульфидных руд, содержащих соединения железа;
- сжигание кокса с использованием горячего продува;
- восстановление оксида металла угарным газом;
- соединение углерода с железом и расплавление чугуна.
В чугуне в виде зерен всегда находятся включения графита и соединения железа с углеродом (цементит). Из чугуна производят сталь путем переплавки в мартеновских, электрических печах.

Для получения разных марок стали в состав материала вводятся лигатурные добавки других компонентов. Химически чистое железо в промышленности производят путем электролиза раствора солей металла или восстановлением оксидов водородом.
Состав материала определяет сферы его применения. Чистый металл используется в производстве особых сплавов, предназначенных для изготовления сердечников для электромагнитов. Из чугуна путем литья изготовляют посуду, его используют как материал для производства стали.
Оксиды металла и их нахождение в природе
Реакция окисления железа происходит в естественных условиях. В зависимости от степени окисления соединение приобретает свойства, определяющие его применение.
- Простой оксид железа FeO является амфотерным соединением с преобладающими основными свойствами. Он не взаимодействует с водой, восстанавливается водородом и медленно окисляется на воздухе. Соединение применяют в качестве компонента минеральных красок и керамических изделий.
- Двойной оксид металла в природе находится в магнетите. Соединение является термически устойчивым, его наносят на поверхности изделий из стали. Этот процесс обработки известен под названием воронение или чернение металла.
- В оксиде металла Fe2O3 преобладают основные свойства, он медленно реагирует со щелочами и кислотами. Гематит является рудным сырьем, содержащим соединение металла. Его применяют при выплавке чугуна, в качестве катализатора при производстве аммиака, производстве красок, цемента, как полирующий материал для стекла и стали.
V. Характерные степени окисления железа.
I. Строение атома.

Fe +2 , Fe +3 — основные степени окисления
Fe +6 —очень редко, в солях железной кислоты (K2FeO4)
II. Физические свойства.
Fe —металл серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Железо относится к умеренно тугоплавким металлам. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
III. Химические свойства.
Железо относится к металлам средней активности.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
1. Взаимодействие с кислородом.
Железо горит в кислороде, нагретое горит на воздухе.
| 150 — 600°C |
| t |
Пропускание кислорода или воздуха через расплавленное железо:
| t |
2. Взаимодействие с серой.
3. Взаимодействие с углеродом.
Fe + C → Fe3C (карбид железа)
4. Взаимодействие с азотом.
| t |
Fe + N2 → Fe3N ( нитрид железа)
5. Взаимодействие с хлором.
| t |
2Fe + 3Cl2 → 2FeCl3 (хлорид железа)
| t |
6. Взаимодействие раскалённого железа с водяным паром:
7. Взаимодействие с кислотами.
8. Особенности взаимодействия железа с концентрированными H2SO4 и HNO3.
| t |
Fe + H2SO4 (конц)→ пассивирует
Fe + HNO3 (конц)→ пассивирует
С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
9. Взаимодействие с растворами солей — железо способно восстанавливать металлы, стоящие в ряду активности правее него.
10. Железо восстанавливает соединения железа (III):
11. Железо, при повышенном давлении, реагирует с несолеобразующим оксидом – СО с образованием веществ сложного состава – карбонилов — Fe(CO)5, Fe2(CO)9 и Fe3(CO)12.
IV. Получение железа
Основной способ получения железа – из железной руды (гематит (Fe2O3) , магнетит (FeO·Fe2O3)) или электролиз растворов его солей (в этом случае получают «чистое» железо, т.е. железо без примесей).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Химизм доменного процесса следующий:
FeO + CO = Fe + CO2.
V. Характерные степени окисления железа.
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
| +2 | FeO | Fe(OH)2 | Слабоосновный | Слабый восстановитель |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | Слабый окислитель |
| +6 | Не получен | * | Кислотный | Сильный окислитель |
* Кислота в свободном виде не существует — получены только её соли.
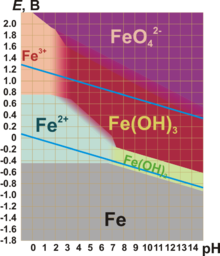
Для железа характерны степени окисления — +2 и +3.
Соединения Fe +2 .
FeO — основный оксид черного цвета, в воде не растворим, растворим в к кислотах, бурый железняк.
При взаимодействии с водородом при температуре 350 о С и коксом при температуре выше 1000 о С восстанавливается до чистого железа.
Получают оксид железа (II) разными способами:
1. В результате реакции восстановления оксида трёхвалентного железа угарным газом.
2. Нагревая железо при низком давлении кислорода
3. Разлагая оксалат двухвалентного железа в вакууме
4. Взаимодействием железа с оксидами железа при температуре 900-1000 о
Fe(OH)2 — кристаллическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде. При нагревании разлагается.
1. Взаимодействие с кислотами.
2. При нагревании реагирует с концентрированными растворами солей аммония
| 150 — 200°C |
3. При нагревании разлагается.
4. Fe(OH)2 не устойчив, легко окисляется.
Получение Fe(OH)2.
1. В виде осадка в обменных реакциях растворов солей железа(II) со щёлочью
2. Образование гидроксида железа(II) является одной из стадий ржавления железа:
Качественные реакции на Fe +2
1. Pеакция с красной кровяной солью (гексацианоферрат калия K3[Fe(CN)6]).
турнбуллева синь(гексацианоферрат (II) железа (III) — калия)
Появление турнбуллевой сини доказывает присутствие в растворе ионов железа (II).
2. Pеакция со щелочью.
Соединения Fe +3 .
Fe2O3— оксид, проявляющий слабоамфотерные свойства, порошок бурого цвета, в воде не растворим. В природе встречается как минерал гематит.
Fe2O3 имеет и другие названия: окись железа, железный сурик, крокус, пигмент красный 101, пищевой краситель E172.
Может взаимодействовать как с кислотами, так и со щелочами.
1. Взаимодействие с кислотами.
2. Взаимодействие со щелочами.
3. Взаимодействие с солями щелочных металлов.
4. При температуре выше 1400°С разлагается:
1. Термическое разложение гидроксида железа (III)
2. Окисление пирита
Fe(OH)3 — образуется в виде осадка, называемым ржавчиной коричнево-бурого цвета, слабоамфотерный гидроксид с преобладанием основных свойств. В воде нерастворим. Легко образует коллоидные растворы.
1. Взаимодействие с кислотами.
2. Взаимодействие с концентрированными растворами щелочей.
гексагидроксоферрат (III) натрия
При сплавлении со щелочами или щелочными реагентами образует ферриты:
3. При нагревании разлагается:
Получение Fe(OH)3.
Соли железа (III).
Железо (III) образует соли практически со многими анионами.
В растворе соли железа (III) значительно более устойчивы, чем соли железа (II). Растворы солей имеют желто-бурую окраску и, вследствие гидролиза, кислую среду:
Fe 3+ + H2O = FeOH 2+ + H + .
Соли железа (III) гидролизуют в большей степени, чем соли железа (II), по этой причине соли железа (III) и слабых кислот нельзя выделить из раствора, они мгновенно гидролизуют с образованием гидроксида железа (III):
Проявляют все свойства солей.
Обладают преимущественно окислительными свойствами:
Качественные реакции на Fe 3+
1. Взаимодействие с гексацианоферратом (II) калия (желтой кровяной солью) :
осадок синего цвета
берлинская лазурь (гексацианоферрат (III) железа (II) — калия)
2. Взаимодействие солей железа (III) с роданидом калия или аммония:
Но стоит только к кроваво-красному раствору роданида железа добавить раствор фторида натрия, как он становится совершенно бесцветным. Образуется очень прочный комплексный ион [FeF6] 3- , при этом роданидный комплекс разрушается:
Реакция со щелочью.
В природе встречается как минерал магнетит, или магнитный железняк. Он является хорошим проводником электрического тока и обладает магнитными свойствами. Образуется при горении железа и при действии перегретого пара на железо.
1. Нагревание при температуре 1538 о С приводит к его распаду
2. Вступает в реакцию с кислотами
3. Со щелочами реагирует при сплавлении
4. Вступает в реакцию с кислородом воздуха
5. Восстановление происходит при реакции с водородом и монооксидом углерода
Соединения Fe +6 .
H2FeO4 в свободном состоянии не существует.
