Как сделать карбид в домашних условиях?
Что такое карбид? Описание, особенности, применение и цена карбида
Что такое карбид?
Самодельные бомбы. Вот, что приходит на ум первым делом, когда слышим слово карбид. И нет, занимались производством этих опасных игрушек не предприятия оборонной промышленности, а, как правило, мальчишки, лет так десяти.
Лет двадцать назад это было излюбленное развлечение у подростков. Это сейчас все сидят за своими планшетами, а тогда миром правил пытливый ум ребенка, который норовил все испробовать на практике.
Для того, чтобы почувствовать себя Рембо, требовалось раздобыть один чудо-камешек. Находили их дети чаще всего на стройках. А дальше все было просто: пластиковый сосуд, камень, вода, плотно закрученный колпачок. Все это рьяно трясли, и в лучшем случае, отбрасывали куда подальше. А в худшем «снаряд» разрывало прямо в руках, тогда травм было не избежать.

Карбид кальция
Были и более безопасные пути использовать находку, к примеру, просто бросить в лужицу, тогда можно было наблюдать нечто похожее на действие современных бомбочек для ванны. Так что это за популярная «игрушка». Большинство из нас считали, что таким, как мы его знаем, карбид произвела природа. Но на самом деле это не так. И сегодня Вы в этом убедитесь.
Итак, вещество это всегда очень твердое, плюс ко всему, чтобы его расплавить, нужно приложить недюжинные усилия. На вид это темные, светлые, зеленоватые камни, либо порошок, все зависит от состава. Срок его годности недолог, как правило это полгода. Уложить емкости в общий склад не получится, у таких потенциально опасных веществ должен быть свой отсек.
Как Вы уже знаете, карбид постоянно норовит взорваться. Причем, некоторым соединениям даже особых условий не надо. Достаточно просто пересыпать порошок из тары в тару, как он может неожиданно рвануть.
Свойства и состав
Чтобы получить этот камень, нужно, как минимум, два элемента. Во-первых, это углерод. Его наличие обязательно. А дальше уже есть выбор: металл, или неметалл. Главное, чтобы выполнялось правило: электроотрицательность (сила, с которой атомы элемента притягивают к себе чужие электроны) обязательного компонента выше, чем его «партнера». Иначе получатся совсем другие соединения.

Формула карбида кальция
Впервые об этом соединении заговорили в Англии еще в 19-м веке. Однако, слава первооткрывателя досталась французу, благодаря опытам которого вещество официально признали, случилось это лишь к концу столетия. А теперь от том, какие качества присущи этому соединению:
- Материал необычайно твердый. По этому показателю он почти догнал алмаз. Среди рекордсменов – карбид вольфрама (9 из 10 возможных баллов). Это открывает сотни путей его применения.
- Чтобы расплавить камень, нужно будет приложить немало усилий. Ведь для этого необходимо нагреть его до 2-х, или даже 3-х тысяч градусов Цельсия. Эта цифра будет выше значений, необходимых для того, чтобы изменить состояние металлических веществ, до того, как они оказались в составе карбида.
- Это очень «не контактное» соединение. Так, реакция карбида на очень многие вещества будет нулевой. Для этого нужны особые условия. Потому кислоты, и прочие вещества, способствующие коррозии, им не страшны.
- Но предыдущий пункт не касается воды. Как Вы уже поняли из рассказа выше, карбид и вода – часто идут рука об руку. В случае, к примеру, когда задействован карбид кальция, для этого подойдет абсолютно любая влага, не нужно никаких условностей. Если же в работе карбид кремния, то без нагрева никак – нужен раскаленный пар (1800 градусов).
Науке известны три разновидности таких соединений:
Что их отличает, так это очень прочные связи между атомами. Когда упоминается такой тип, то речь лишь о двух элементах, соседствующих с углеродом: первый – это бром, второй – кремний. Все вышеперечисленные свойства в этих соединениях «выставлены» на максимум. Это и небывалая твердость, и стойкость. Захотите растворить – не получится без участия едких кислот огромной концентрации. Тоже самое касается и взаимодействия с кислородом. Просто так не получится, нужен нагрев, и не хилый – до 1000 градусов.
- Солеобразные, либо ионные
Здесь в контакт с углеродом вступает либо алюминий, или металл, но не абы какой, а только из 1-2 групп хим. таблицы. Придать такому соединению жидкую форму все еще не очень просто, нужен предельный нагрев. А вот кислота незамеченной не останется, в результате такой «встречи» карбид распадется.
- Металлоподобные
Получаются они из металлов, относящихся к 4-8 группе, сюда же идут кобальт, а также никель, ну и, конечно, железо. Если рассматривать их химическое строение, увидим, что атомы углерода буквально разбросаны, между ними нет связей, они словно вкрапления в образовавшихся в металле пробелах. Потому то они весьма тугоплавкие, можно даже сказать, чемпионы в этом деле. Это позволяет применять их при изготовлении сверл (победитовые сверла).
Применение
Как уже упоминалось, чаще всего это вещество можно встретить на стройке. И там ему находят десятки способов применения. В шлифовке без этого материала трудно обойтись, из него производят спец. диски. Но хорош он не только в качестве абразива, но и в виде острых режущих кругов, ножей и тому подобного.

Генератор ацитиленовый для газосварки, внутрь которого засыпается карбид кальция
Машиностроение – еще одна возможность использовать это соединение. Из карбида получаются не только различные детали автомобилей, но и зап. части для радио приборов. А благодаря своей теплопроводности он отлично справится и с задачей нагревательного типа. Даже в ядерной промышленности без такого составляющего никак. Все это требует особой прочности, поэтому здесь речь чаще всего о ковалентных видах.
Те составы, что содержат карбид железа, позволяют получить сталь, и всем известный чугун. Кремниевые соединения так же ценят ювелиры и производители осветительных элементов. Искусственный каучук и смолы, и даже уксусная кислота – настолько широк круг применения карбидов.
Но этим дело не ограничивается. Этот искусственный минерал еще и для огородников важен. Ведь с его помощью получают особый вид удобрений. Они способны регулировать скорость роста различных культур.
Но, пожалуй, самый популярный из всех – карбид кальция. Ведь именно его в своей работе активно используют сварщики. Казалось бы, как этот темный камушек с чесночным ароматом может быть задействован в таком процессе?
Очень просто, ведь для газовой сварки, что логично, нужен горючий газ. В нашем случае дает карбид ацетилен. Как только он «встречается» с кислородом, мы получаем весьма интенсивное пламя, его температурные показатели переступают отметку в три тысячи градусов.
Если брать уже готовый летучий газ, то упаковкой ему служат спец. емкости, в них вещество доставляют к месту действия. Никакой тряски, или ударов во время такой поездки быть не должно – смертельно опасно.
Это сырье может вспыхнуть, даже без лишней «помощи», потому внимание всегда должно быть на пределе. Если же пожара избежать не удалось, никакой влаги при тушении. В ход должны идти только порошковые способы тушения.

Есть второй путь – произвести это «топливо» прямо на месте работ. Для этого нужно знать, что такое гидролиз карбидов. Говоря проще, это реакция соединения на контакт с водой. Причем, этот самую реакцию может вызвать даже одна капля.
Потому, если собрались осуществить сварочные работы, предельно аккуратно вскрываем герметичную тару с карбидом. Особо важно, чтобы никаких признаков огня по соседству, иначе ЧП гарантированно. О сигаретах и вовсе стоит забыть.
Еще следите за тем, чтобы даже самые мелкие крошки не оказались на Вашей коже, тем более на слизистых, иначе, в лучшем случае – раздражение, с худшем- ожоги и распухшие части тела. Так что вооружайтесь спец. обмундирование: защитить нужно все, с ног до головы, в том числе и дыхательные пути. Первая помощь, если контакта избежать не удалось: обильно поливаем водой пораженный участок, покрываем его плотным кремом. При необходимости вызвать врача.
Если говорить о расходе, если масса карбида один килограмм, то это дает возможность выработать до трехсот кубических дециметров газа. Это достаточно хорошие показатели. Так же на такое количество сырья потребуется примерно литров 20 воды, хотя производители и заявляют, что достаточно будет полулитра. То, сколько времени все это займет, зависит от величины фракций соединения, и их чистоты.
После того, как с работой закончили, оставшиеся отходы, а это шлак из извести, не оставляем где попало, а утилизируем. Для таких работ потребуется спец. генератор. Бывают они внушительных размеров, их устанавливают на одном месте, к примеру, когда планируются масштабные работы. Но существует и мини-версия, переносная.
Сначала отсек, в котором и должен образоваться газ, заливаем водой, потом уже добавляем туда карбид. Идет реакция, появившийся в результате ацетилен по мягкой трубке поступает непосредственно к газовой горелке. Этот путь должен быть достаточно длинным, шланг обязательно нужно выбрать не короче десяти метров.

Карбид бора
Идет в дело и карбид бора. Предметы на его основе дают надежную защиту от огня. И не только от огня, кстати, ведь такой товар активно используют изготовители бронежилетов. Во-первых, он «ловит» пули, а во-вторых, не даст прохода и радиации. Что касается такого союза, как карбид алюминия, то сверкающие искры во время фейерверков – его заслуга. А ведь на вид это ничем не примечательный желтый порошок.
Как получают карбид?
Сначала о карбиде кальция. Его производство – дело востребованное. И хотя такие заводы требуют больших трат, особенно когда речь заходит об электроэнергии, предприятия от привычного способа изготовления не отказываются. Потому как спрос на такую продукцию не спешит падать. Ведь без ацетилена вряд ли можно представить хоть одну стройку. Чтобы экономить на электричестве, подобные предприятия открывают в странах с большим количеством ГЭС, в Канаде, например.
Почему же не перейти на работу с метаном, ведь из него тоже можно получить такой летучий газ? Да потому, что карбид кальция дает практически чистый продукт, довести до ума 98-ми процентный газ несложно. И перевозить его гораздо проще, чем тот, что получен при участии метана.
Главным объектом на таких производствах выступают электрические печи. В них загружают твердый уголь, который еще зовут коксом, и оксид кальция (известь, причем абы какая не подойдет, нужна очищенная и однородная). Все это раскаляется до 2-х тысяч градусов. И вуаля, реакция пошла.

Как результат жидкая субстанция, которая и станет потом привычным нам соединением. Но сначала ей нужно охладится в формах. После того, как градус снижен, эти пласты дробят на более удобные в использовании куски.
Теперь о кремниевом варианте. Получили его абсолютно случайно, как это по обыкновению бывает. Американский ученый пытался создать искусственный алмаз. В результате экспериментов произошло получение карбидов кремния (они, кстати, на втором месте по твёрдости после не ограненного бриллианта).
Он его запатентовал и открыл первый завод по производству материала. Сказать, что технология с тех пор сильно изменилась – нельзя. Разве что из нее исключили песок и соль, остался углерод и кремнезём, которые все так же накаляют до максимальных температур в печах.
Если говорить о соединении с кальцием, то за один килограмм придется выложить около 80-ти рублей. Когда речь идет о кремнии в составе, накидывайте сверху еще пару рублей. Алюминиевая производная также доступна по цене, потратиться придется в пределах сотни. В такую же сумму обойдется карбид титана, молибдена и хрома.

Теперь о более затратных вариантах, к примеру, карбид вольфрама – покупка не из дешевых. Приготовьте около полутора тысяч рублей, с которыми придется распрощаться, приобретая 1000 граммов сырья.
Есть еще один «приятный» бонус, изготовитель может ограничить Вас в выборе количества приобретаемого товара, ведь многие указывают, что Вы обязаны купить минимум 10 килограммов. А если намерены приобрести состав с бором, то и того не легче – меньше 30-ти кило Вам вряд ли кто-то продаст, в то время как 1 кг. вылетит аж в 2 тысячи рублей.
Карбид кальция: свойства и применение. Получение ацетилена
Карбиды – это группа неорганических соединений углерода с металлами, а также с кремнием или бором (поскольку эти элементы проявляют металлические свойства). Карбид кальция – одно из наиболее востребованных веществ этой группы. О свойствах и применении соединения читайте ниже.
История получения
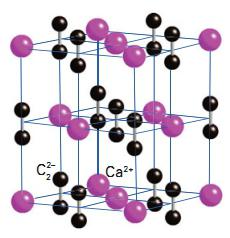
Карбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид. Химическая формула соединения – CaC2. Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом:
Физические свойства
По своим физическим свойствам карбид кальция является кристаллическим веществом с температурой плавления 2300 о С. Эта цифра является справедливой лишь для чистого соединения. Карбид, содержащий примеси, может иметь другие показатели температуры плавления. Основное агрегатное состояние вещества – твердое, а цвет варьирует от серого до коричневого.
Химические свойства
Карбид кальция хорошо впитывает воду. Этот процесс сопровождается химической реакцией разложения. Важно, что карбидная пыль обладает раздражающим действием на слизистые оболочки, кожу и органы дыхания. Поэтому во время работы с соединением необходимо использовать противогазы либо противопылевые респираторы. С кислородом карбид кальция взаимодействует при высокой температуре с образованием карбоната кальция. Реакция с азотом приводит к синтезу цианамида кальция. Также при высоких температурах карбид кальция вступает в реакции соединения с хлором, фосфором, мышьяком. Но все-таки одним из важнейших свойств соединения считается разложение водой.

Получение
Производство карбида кальция заключается в следующем. Негашеную известь и предварительно измельченный кокс смешивают. Полученную смесь подвергают расплавлению в электрических печах. Кокс и оксид кальция берутся в равных по массе частях. Процесс происходит при температуре 1900 о С. Расплав выходит из печи и в дальнейшем разливается по специальным формам. Затем уже затвердевший карбид кальция дробят и сортируют по размеру кусков. Гранулы вещества разделяются на четыре фракции в соответствии с их размерами: 25×80, 15×25, 8×15, 2×8, которые определяются ГОСТом 1460-56. По своему составу технический карбид кальция содержит 75-80% основного вещества. На долю примесей, таких, как углерод, известь и других, приходится до 25% от общей массы полученной смеси. Кроме того, содержащийся в техническом карбиде сульфид и фосфид кальция обусловливают довольно неприятный его запах. Представим реакцию получения СаС2: СаО + 3С → СаС2 + СО↑. Образование ацетиленида кальция сопровождается поглощением тепла. Поэтому логично предположить, что реакция его разложения, напротив, идет с выделением энергии.

Транспортировка и хранение
По причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения. Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.

Применение
Область применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ. В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом. Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы.

Производство ацетилена
Одной из важнейших областей применения карбида кальция является его использование в получении ацетилена. Заслуга в открытии этого способа также принадлежит немецкому ученому-химику Фридриху Велеру. В основе этого промышленного процесса лежит реакция разложения карбида под воздействием воды. СаС2 + 2 Н2О → С2Н2 + Са(ОН)2↓. На выходе образуется газ ацетилен и гашеная известь, выпадающая в осадок. Процесс сопровождается выделением большого количества тепла. Объем газа на выходе зависит от того, насколько чистый используется для реакции карбид кальция. Ацетилен, образующийся в результате, может иметь различный объем – 1 кг исходного вещества может дать от 235 до 290 литров газа. Что касается скорости протекания реакции, то она зависит как от малого процента примесей в карбиде кальция, так и от температуры воды, а также ее чистоты. Если рассматривать теоретическую реакцию производства ацетилена из карбида, то в ней на 1 кг карбида достаточно 560 мл воды. Однако на практике объем воды для проведения реакции увеличивается. На 1 кг карбида кальция в условиях промышленного синтеза требуется от 5 до 20 литров воды. Такое количество необходимо для того, чтобы ацетилен лучше охлаждался, а также для обеспечения оптимальной безопасности при работе. Ниже изображен немецкий химик Фридрих Велер.

Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот.
Методы получения карбидов
Карбиды могут быть получены взаимодействием углерода и его соединений с металлами или их соединениями. Известны следующие способы получения карбидов:
1) получение карбидов в литом виде;
2) науглероживание порошков металлов (или окислов) твердым углеродом;
3) науглероживание порошков металлов (или окислов) газами, содержащими углерод (часто в присутствии твердого углерода);
4) осаждение из газовой фазы (метод наращивания);
5) химическое выделение карбидной фазы или углеродистых ферросплавов или расплавов (метод растворения);
6) электролиз расплавов соответствующих солей.
Промышленное применение имеют первые три способа.
Получение литых карбидов основано на сплавлении металлов с углеродом и возможно только в электрической или высокочастотной печи, так как температуры образования и плавления карбидов тугоплавких металлов лежат в пределах 2500—4000° С. Это вызывает определенные технические трудности, поэтому способ получения литых карбидов имеет ограниченное применение.
Получение карбидов науглероживанием порошков металлов или окислов металлов твердым углеродом имеет наибольшее распространение и используется для промышленного приготовления карбидов вольфрама, титана, молибдена, тантала, ванадия и других карбидов, применяемых в производстве твердых сплавов.
В качестве исходного сырья при этом способе используют порошки чистых металлов или их окислов. Углерод вводят в смесь в виде тонкого порошка сахарного угля или сажи. Смесь металла (или окисла) с углеродом тщательно перемешивают в шаровых мельницах всухую или мокрым способом. При смешивании металла с твердым углеродом дают от 5 до 10% избытка углерода (по сравнению с теоретическим содержанием его), так как в металлических порошках имеется остаточный кислород, а также для компенсации частичного выгорания углерода в печи.
При использовании смесей окислов металла с углеродом учитывают науглероживающее действие образующейся окиси углерода и применяемого защитного газа. Обычно для реакции достаточно 80—90%-ного количества углерода, которое соответствует уравнению

Науглероживание (карбидизацию) проводят в одну или несколько стадий в электрических или реже в газовых печах. Кроме муфельных печей непрерывного действия, применяют угольные трубчатые печи сопротивления, методические печи с молибденовыми нагревателями и вертикальные трехфазные криптоловые печи, а также высокочастотные печи периодического действия с графитовыми тиглями.
В качестве защитного газа используют водород, окись углерода, метан и смеси этих газов. При получении карбидов волфрама и молибдена в качестве защитного газа можно использовать генераторный газ или диссоциированный аммиак.
Реакция науглероживания при образовании монокарбидов протекает по следующим уравнениям:


Карбиды молибдена, вольфрама и тантала лучше всего получать науглероживанием металлических порошков сажистым углеродом при температуре 1200—1600°С.
Вольфрам образует два стойких при комнатной температуре карбида: W2C и WC. При науглероживании в твердом состоянии образуется преимущественно монокарбид вольфрама WC, при науглероживании в расплаве образуется W2C. Металлокерамические твердые сплавы содержат исключительно монокарбид вольфрама.
Карбид титана готовят из смеси возможно более чистой двуокиси титана с газовой сажей при температуре 1700—2100° С.
Получение карбидов науглероживанием металловили окислов углеродсодержащими газами. Выше было показано, что при карбидизации в твердом состоянии науглероживание частично происходит и через газовую фазу. В связи с этим возможно получение карбидов науглероживанием исключительно через газовую фазу. Для этого обычно используют металл и углеводород, в результате реакции получают карбид металла и водород. Газовая карбидизация металлов происходит при более высокой температуре.
Науглероживание окислов углеродсодержащими газами проводится редко.
Получение карбида кальция для сварки и выход ацетилена из карбида

Карбид кальция (CaC2) нашёл своё применение в газовой сварке металлов, так как способен выделять большое количество газа – ацетилена (С2Н2). Для этого его засыпают в ацетиленовый генератор, в который заливается вод.
Получение ацетилена из карбида кальция возможно при контакте его с водой. Помещённый карбид в воду, моментально вступает в бурную реакцию. При этом он распадается на гашёную известь с образованием горючего газа.
Химическая формула реакции получения ацетилена из карбида кальция: СаС2 + Н2О = С2Н2 + Ca(ОН).
Горит ацетилен в смеси с кислородом примерно при Т= 3150ºС. Такая особенность позволила применять карбид для сварки и пайки различных металлов газом.
Было научно доказано, что при использовании 1 кг CaC2 с 0,5 л воды, получится 370 л С2Н2 и 1 кг гашённой извести.
Способы получения карбида кальция
Способ получения карбида состоит из следующих этапов:
1. Добытый известняк подвергается отжигу.
2. Смешивая и измельчая известь с коксом, получают шихту.
3. Полученная шихта расплавляется в печах. В процессе расплавления шихты образуется карбид кальция.
4. Полученный карбид измельчается.
Измельчается карбид на гранулы разного размера. Чем больше гранула, тем большее количество ацетилена она произведёт. Размер гранул значительно влияет на время выработки газа.

Выход ацетилена из карбида кальция
От качества полученного CaC2, напрямую зависит выход полученного С2Н2 из 1 кг CaC2.
Согласно ГОСТ 1460-46 выход ацетилена из карбида кальция следующий:
Размеры кусков в мм
Выход ацетилена в л/кг
С уменьшением размера куска, уменьшается выход горючего газа. Это связано с тем, что мелкие куски карбида содержат значительно больше посторонних примесей, которые крошатся из-за хрупкости.
Скорость разложения карбида кальция (газообразования)
Под скоростью разложения подразумевается, какой объём ацетилена выделит 1 кг карбида в 1 минуту времени. Данное значение измеряется в л/кг. Это значение напрямую связано с качеством и размером кусков.
Чем меньше размер кусков, тем быстрее произойдёт разложение карбида кальция. Ещё на разложение может влиять температура воды.
Время полного разложения и получение ацетилена с помощью карбида кальция при температуре воды +17ºС приведено в таблице:
| Размеры кусков в мм | Время полного разложения CaC2 в мин | Выход ацетилена в л/кг | |
| 1 сорт | 2 сорт | ||
| 2-8 | 5,5 | 250 | 230 |
| 8-15 | 6,5 | 260 | 247 |
| 15-25 | 8,0 | 270 | 250 |
| 25-50 | 10,0 | 280 | 260 |
| 50-80 | 13,0 | 280 | 270 |
При температуре воды в 20ºС выработка ацетилена из карбида может приостановиться. Если температура воды составляет 40 – 80ºС, тогда процесс газообразования идёт очень медленно. Заиливание происходит только с большими кусками.
Техника безопасности

В связи с тем, что карбид относится к классу взрывоопасных веществ, к хранению его предъявляются следующие требования:
1. Место хранения должно быть сухим. Не допускается хранение возле мест с открытым огнём.
2. Запрещено хранить карбид в гранулах до 2 мм и применять его в генераторах. Это связано с тем, что мелкие гранулы быстро реагируют с водой, что приводит к избыточному давлению в сосуде.
3. Работать с карбидной пылью следует с применением СИЗ.
4. Если карбидная пыль попала в глаза, тогда следует их промыть тёплой воды и обратится к врачу.
5. Перед использованием генератор следует проверить на предмет отсутствия трещин в корпусе.
6. При использовании ацетиленового генератора в помещении запрещено. Размещать его следует на открытом участке с хорошей вентиляцией.
7. Размещать генератор рядом с кислородным баллоном запрещается.
8. Запрещается вскрывать генератор в близи открытого огня.
Как сделать карбид кальция в бытовых условиях?
Или где можно купить? Нужно совсем немного для подкормки ананасов.
![]()
Метод получения вещества заключается в том, что атом кислорода в молекуле оксида кальция меняется на два атома углерода. В промышленности это достигается более сложнотехнологически м процессом, но в «домашних условиях» всё иначе.
- Смешиваем негашеную известь и ко**(1:1) и выкладываем смесь в тигель.
- Далее, возьмём два провода, один присоединим к тиглю, а второй цепляем графитовый электрод и подадим электропитание.
- После проделанных манипуляций замыкаем цепь. Погружаем электрод в смесь, и за счет углерода, между элементами создается электрическая дуга, следственно протекает ток, смесь разогревается и местами даже плавится.
- Необходимо постараться проплавить ее по всей площади. После того, как остынет, расплав местами будет содержать карбид кальция. Если погружая расплав в воду выделяется горючий газ ацетилен, то всё сделано верно, соответственно инструкции.
А купить: http://msk.pulscen.r u/products/karbid_kal tsiya_meshok_86687030
![]()
Ряска полезна для человеческого организма.
С ее помощью проводят профилактику такой болезни, как витилиго (пьют отвар из ряски).
Также, ряску используют в аквариумах.
По поводу удобрения — пусть она в компостной яме подгниет, тогда ее можно использовать в качестве удобрения. Вреда в себе никакого она не несет.
![]()
Сажу, я думаю, нельзя. А вот зола — очень ценный продукт, как удобрение. И даже если в ней имеются гвозди (иногда в качестве дров мы используем разобранную мебель, забор и т.д.), это только почве на пользу.
![]()
Я решаю данную проблему двумя способами: методом компостирования и методом грядок-коробов. Для компостирования на понадобиться компостная куча, причем именно куча, а не яма, в которой чрезмерная влажность, малый доступ воздуха-гниение не идет, получается что-то вроде кислого силоса. Для создания компостной кучи делаем короб из досок: передней стенки нет, задняя длиной два-три метра, боковые метр-полтора (в зависимости от требуемоего количества компоста), ставим разделительную среднюю стенку чтобы получилось два одинаковых отсека. Дерево, само собой, хорошо обрабатываем составом от живности и гниения по инструкции средства, причем в идеале найти основанное на биологическом действии вместо химического (свое здоровье дороже). По моему мнению дерево наиболее оптимальный материал, хотя и поддающийся гниению и заселению муравьями (если появятся сразу обработать средством от муравьев из специализированного магазина) в отличии от плоского шифера, который слишком хрупок и может расколоться при перекопке и кирпича-соседи по даче сделали очень красивое не побоюсь этого слова сооружение из красного кирпича, причем гармонирующее с остальными постройками, так на третье лето он практически весь раскрошился наверное от избыточной влажности. Делать кучу надо в тени, иначе будет быстро сохнуть и процесс компостирования остановиться, сверху накрывать: летом чем-то непрозрачным, поздней осенью, зимой, ранней весной можно прозрачной пленкой- под ней в солнечные дни будет эффект парника, накрывать обязательно, иначе до половины полезных веществ будет вымыто дождями. Пол земляной, так будет свободный доступ червям и возможность им уйти в землю на зимовку. Вот в принципе и все про устройство, теперь о том, что можно компостировать. Нельзя класть мясные и костные продукты (привлекают крыс и мышей), синтетику, пластмассы, стекло, металл (не гниет), остатки лакированного дерева (зачем нам химия) а все остальное пожалуйста. Укладываем на дно кучи старые опилки, солому, сено или хорошо провяленную траву (свежую траву и резку с газонокосилки всегда провяливать что-бы не было избыточной влажности) слоем десять-двадцать сантиметров, затем все остальное, что найдется: навоз, птичий помет, кухонные отходы, некоторые добавляют разведенные водой и настоенные дней пять фекалии (человеческие, не в коем случае кошачье-собачии). Можно добавлять сухие листья, срезанные мелкие ветки деревьев и кустарников, порезанные секатором как можно мельче (быстрее сгниют), ломаные початки кукурузы, туалетную бумагу, все сорняки с грядок, остатки овощей (стебли, листья, капустные кочерыжки, жмых от приготовления яблочного сока). Хорошо для затравки пролить ЭМ «Байкал» (я пользовался им, цена одного литра препарата в магазине 150-160 рублей) или аналогом (применять по инструкции) и добавить на развод червей. При засухе поливать, раз в месяц перемешивать, можно перекидывать в соседний отсек, если он не занят приготовленным ранее компостом, как можно сильнее измельчать компоненты закладки, траву подвяливать. При таком методе к следующей весне компост будет готов, а если перекидывать раз в неделю, то и к осени.
Теперь про грядку-короб. Доски обрабатываем биозащитой, собираем прямоугольный короб шириной метр, длиной по размеру грядки, ставим его на выравненную поверхность почвы и заполняем его. Вниз кладем срезанные не толстые ветки плодовых деревьев и кустарников (будут дольше гнить), засыпаем готовы компост, а если его недостаточно, сначала не ветки землю, а верхним слоем готовый компост. После посадки растений заваливаем их травяной мульчой (сорняки, резка из газонокасилки, сено). Она способствует сохранению влаги, постепенно перегнивает, сама превращаясь в удобрение, одно плохо-быстро усыхает, приходится часто добавлять. За лето компост сильно оседает, поэтому каждую весну добавляем новый из компостной кучи. Грядку-короб не копать и по ней не ходить, так как земля в ней становится очень рыхлой под воздействием работы червей и микроорганизмов, так же полезно засевать сидератами (лучше горчица, горох) и подрезав их плоскорезом или тяпкой оставить в грядке в то время, когда она отдыхает от овощных культур.
![]()
В совсем уж герметичной, конечно, не надо, так как для успешного гниения нужен доступ воздуха. Но и оставлять посуду открытой нельзя. Через недельку увидите реакцию соседей. 🙂 Так как пахнет это удобрение куда хуже навоза. Скорее напоминает по запаху рвотные массы. Да и вода будет испаряться, что нехорошо.
Крапивы (не только! другая мягкая трава не слишком «заразных» качеств, из пырея лучше не делать) надо набить полную посуду, затем это все залить водой — обычной холодной из-под крана, и оставить так в закрытой посуде. Но герметика. — это чересчур по-моему.
Мы дома делаем в обычном старом баке для белья, только закрываем крышкой. Но если выбирать полную герметику или открытую посуду, я бы все же выбрала герметику, потому что не надо раздражать тех, кто живет рядом. Ведь участки обычно небольшие и все запахи прекрасно доходят до соседских домов. Да и самому же будет неприятно нюхать отвратительное «амбре».
![]()
Желудок у слона однокамерный, значит навоз будет схож с конским. Коровий в этом смысле более ценный. Но вот сложить из него грядку под огурцы целесообразно. Единственное только, что предварительно его нужно перемешать с соломой, сеном или подстилкой, хотя я думаю, что у слона ее не бывает в зоопарках. Почему, потому что он будет «гореть» выделяя очень много тепла и если корешки огурцов, кабачков доберутся до навоза, могут «сгореть». Если вам нет смысла выращивать огурцы, то сложите навоз в плотную кучу и закройте чем- нибудь. При самосогревании не переварившиеся в желудке слона семена сгорят, и осенью вы получите замечательный перегной.
Можно конечно и свежий навоз внести под весеннюю перекопку, но так вы добавите сорняков себе в огород.
