Какая кристаллическая решетка у меди?
МЕДЬ — фундамент цивилизации
Не меньше 9000 лет назад человек уже изготавливал первые предметы из меди. Так говорят археологи и подтверждают их находки из тех древних времен.
Не будь этого металла, вся наша история была бы другой. Именно металл медь стал первой ступенькой в развитии в металлургии и фундаментом цивилизации. Именно с этого металла началось развитие человечества.
От Турции до Египта
История открытия металла затерялась в веках. Кто первый обнаружил металл, кто догадался «обстучать» самородок, чтоб из него получилось лезвие или другой инструмент — неизвестно. Тем более никто не знает, кто додумался «сварить» самородок и залить жидкий металл в форму.

Следующая загадка — кто первым стал плавить из руды металл. Зато известно, что самые древние находки медных изделий и шлак от плавки археологи нашли в современной Турции. Древность несусветная — им до 10 000 лет.
Почему медь?
Племена, жившие в Европе в древности, называли медь и любые металлы «мида». В старинных русских текстах слово «медь» также встречается. Ученые считают слово родственным древнегерманскому «smid» (кузнец); либо производным от Мидия — страны на территории нынешнего Ирана.
По-латыни медь называют купрум (aes cuprium), от острова Кипр. Там было богатое месторождение металла. Плиний пишет:
«…Известно, сколь долго римский народ пользовался лишь медной монетой. Сама древность свидетельствует о важном значении этого металла».
Долгое время главная расхожая монета Римской империи называлась асс (aes).
Сейчас «медь» и «купрум» мирно делят принадлежность к цветному металлу.
Свойства металла

Медь находится в 11-й группе периодической таблицы Менделеева, в так называемой «троице дорогих металлов» — медь, золото, серебро. Атомный номер 29. Цвет металла желтовато-розовый, близкий к оранжевому.
В классификации элемент находится в группе переходных металлов.
Физические свойства оценили давно, и востребованы они до сих пор. Это отменные тепло- и электропроводность. По этим показателям медь уступает только серебру; наличие примесей (олово, железо, мышьяк) показатели ухудшают.
Чистая медь мягкая, ковкая, хорошо поддается прокатке. Проволоку можно довести до диаметра в тысячные доли миллиметра.
Плотность 8,92 г/см3. Плавится при 1083,4 °С, кипит при 2567 °С.
| Свойства атома | |
|---|---|
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
| Атомная масса (молярная масса) |
63,546(3)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1083,4 °С) |
| Температура кипения | 2567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Кристаллическая структура решетки гранецентрическая, кубическая.
Химические свойства элемента привлекательны для промышленности:
- Металлическая медь довольно стабильна и малоактивна. Шпили старых церквей покрывали медными листами, которые исправно защищали кровлю многие годы.
- Проявляет степени окисления 3, 2, 1, 0.
- Металл не растворяется в разбавленных серной и соляной кислотах, а вот концентрированная азотная кислота с медью охотно реагирует.
- Легко реагирует с серой, галогенами (йод, фтор, хлор).
В природе состоит из изотопов 63Cu и 65Cu.
Соединения меди
Чаще всего в природе встречается медный купорос, сульфат меди. Дачники и огородники хорошо знают этот синий порошок. Его применяют для дезинфекции растений от насекомых.
Ацетат меди — фунгицид, компонент краски для керамики.
Парижская (швейнфуртская) зелень, ацетат-арсенид меди. До сих пор используют в окраске наружных частей морских судов (чтобы они не обрастали моллюсками и прочей морской живностью). Фунгицит, инсектицид.
Оксиды используют в окраске стекла и эмалей.
Нитраты применяют для патинирования медных изделий.
Со временем на них образуется естественная патина — зеленоватая оксидно-карбонатная пленка. Иногда патину наращивают искусственно, для состаривания, придания антикварного вида изделию.
Ищем медь
Запасы металла на земле немалые. В их число входит самородная медь (ее скопления могут достигать 400 тонн — бери готовую).
Нет самородной, к услугам человека содержащие медь минералы:
- медный колчедан (халькопирит);
- борнит (сульфид меди и железа); раньше его называли пестрый медный колчедан;
- халькозин, медный блеск (сульфид меди);
- малахит, карбонат меди; уральский малахит высочайшего качества уже использован, теперь малахит добывают в Африке;
- куприт (красная медная руда);
- азурит, медная лазурь.
Месторождения и добыча
Происхождение медных руд разнообразное. Они бывают оксидные, сульфидные, смешанные. Больше всего на земле сульфидных руд (около 90%), в них богатые руды. Не уступают содержанием металла окисленные минералы.
Крупные месторождения есть в Чили (прогнозируемые запасы больше 5 миллионов тонн).

Богатейшие месторождения самородной меди находятся в США (озеро Верхнее), на острове Ванкуве (Канада), Корокоро (Боливия).
Самородная «космическая» медь найдена в метеоритах и на Луне.
В России добыча металла ведется в Красноярском крае (все тот же «Норникель»).
Как выплавить купрум
Способы получения меди:
- пирометаллургический (с его помощью производят 90% металла);
- гидрометаллургический, оставшиеся 10%.
Гидрометаллургия состоит из единственного этапа — обработки руды (обычно бедной) разбавленной серной кислотой с последующим выделением из раствора металлической меди. При этом все попутные вещества из руды просто пропадают.
Пирометаллургия сложнее, там несколько этапов:
- Обогащение методом флотации и окислительного обжига.
- Плавка на штейн при температуре до 1500 градусов. Здесь уже выделяют черновой металл, а также сопутствующие серебро, золото, никель.
- Огневое рафинирование — очистка полученного металла от примесей до чистоты 99,5%.
- Электролитическое рафинирование, доведение чистоты до 99,95%.
Сплавы, лигатуры…
Медь входит в состав множества сплавов:
- мельхиор;
- латунь;
- бронза;
- латтен (латон);
- нейзильбер (применяют в ювелирном деле);
- абиссинское золото;
- французское золото;
- северное золото.
Свойства металла, входящих в сплав, позволяют металлургам «сочинять» требуемые характеристики.
Медь стоит недешево, потому производители предпочитают медные сплавы (там, где это возможно).
В некоторых областях сплавы (особенно с алюминием) уверенно обогнали чистый металл. «Маме»-меди не сравниться с коррозионной стойкостью, прочностью, ковкостью сплавов.
Голубая кровь
Это выражение слышали все. Не все знают, что кровь голубого цвета есть в действительности, но не у людей. Белок гемоцианин окрашивает в голубой цвет кровь моллюсков, многоножек, паукообразных. Сам гемоцианин — аналог гемоглобина, который делает нашу кровь красной.
Без нашего героя человек не смог бы выжить и как биологический вид. Металл способствует усвоению белков, углеводов, укрепляет иммунитет. Не зря наши прабабки варили варенье в медных тазах, ведь металл обладает антисептическими свойствами.
Ионы металла обладают антигрибковыми и противовирусными свойствами, способны проникать через клеточную мембрану и уничтожают распространителей заразы.
Уже существует ткань, содержащая медные нити. Вечернего платья и костюма из нее не сошьешь, вот в больницах она необходима. Материал разработали в Чили.
Применение металла: от телеграфа до фейерверков
Широкое применение меди началось после изобретения телеграфа. Понадобились огромные объемы металла для телеграфных проводов. С этого времени наш герой не покидает первого места в рейтинге электротехнических металлов.
Применение меди основано на ее свойствах. Электропроводка в старых домах; сейчас дорогой металл заменяют на дешевый алюминий. А вот в приборах медные проводки присутствуют. Компьютеры оснащены медными теплоотводами.
Сантехническое оборудование, холодильная техника, кондиционеры — везде задействован цветной металл с его замечательными свойствами.

Корабли и кораблики гордятся медными трубопроводами (в них течет жидкость и газ).
А во многих странах медные трубы применяют для водо- и газоснабжения зданий.
Без меди не будет твердого припоя (это «клей» для металлов).
Диоскурид писал: «Из детской мочи и кипрской меди приготовляется припой для золота».
Япония считает медные трубы газопроводов сейсмостойкими.
Медь применяют как лигатуру для золотых сплавов; чистое золото слишком мягкий и склонный к истиранию металл.
Оранжевый цветной металл дает синий цвет пиротехническим изделиям.
Чего мы не знали о меди
Одно из преимуществ удивительного металла — изготовленные из него инструменты не дают искр при ударе. Разумно использовать их там, где есть вероятность взрыва.
Шведские ученые придумали способ захоронения радиоактивных отходов. Сейчас на это тратятся огромные средства. А можно просто помещать радиоактивный хлам в медные капсулы с толщиной стенок 5 сантиметров. По расчетам, коррозия их разрушит не раньше, чем через полмиллиона лет.
Многие знают, что Статуя Свободы (та самая, с факелом и в короне) изготовлена из меди. Не целиком, конечно, цветной металл только сверху, внутри стальные конструкции. Ходили слухи, что изготовлена она из уральского металла, но… Официально признано, что тот цветмет из Норвегии.
Вот случай, когда вроде полезное свойство нашего героя стало недостатком. Норвежское грузовое судно затонуло по вине медной руды, которую и везло. Виновата электрохимия. Медь из руды создала гальваническую пару с металлическим корпусом судна, электролитом послужили испарения морской воды. Возникший ток спровоцировал такую коррозию, что она проела обшивку, и в трюмы хлынула вода.
Модникам и модницам
Секрет джинсов «Gold Vision-3000» в медном биокорсете. Медные нити, «встроенные» в модные штаны, помогают предотвращать сосудистые патологии, стимулируют работу органов малого таза. А они влияют на пищеварение, половую функцию, кроветворение, уменьшают вредное воздействие бытовых приборов, влияние электромагнитных полей.
На биржу или в Лагич?
Биржевая цена за тонну меди сегодня доходит до 5200 $ США.
Не хотите покупать металл тоннами, а желаете иметь красивое и полезное украшение для дома — поезжайте в Азербайджан, в село Лагич. Там испокон развивалось ремесло медников. Их посуда — чаши, кувшины, блюда — совершенны в своей красоте.
Покупайте их смело. Не зря ведь в Лувре, Венском и Бернском музеях хранятся образцы творчества азербайджанских мастеров медных дел.
1.Металлы. Строение и свойства металлов. Металлическая связь. Типы кристаллических решёток металлов. Полиморфизм и анизотропия.
Объемно-центрированная кубическая (ОЦК) (2 атома на ячейку), б)
Гранецентрированная кубическая (ГЦК) (4 атома на ячейку), в)
Гексагональная плотноупакованная (ГП) (6 атомов на ячейку), г)
Рис. 2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 2, б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряется в нанометрах (1 нм = 10 -9 м =10 A). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра – сторону шестигранника а и высоту призмы с. Когда отношение с/а =1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 1, г). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357-0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.

Рис. 3. Координационное число в различных кристаллических решетках для атома А: а) – объемноцентрированная кубическая (К 8); б) – гранецентрированная кубическая (К 12); в) – гексагональная плотноупакованная (Г 12)
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
В ОЦК решетке (рис. 3, а
) атом
А
(в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К 8).
В ГЦК решетке (рис. 3, б)
атом
А
(на грани куба) находится на наиболее близком равном расстоянии от четырех атомов
1
,
2, 3, 4,
расположенных в вершинах куба, от четырех атомов
5, 6, 7, 8,
расположенных на гранях куба, и, кроме того, от четырех атомов
9, 10, 11, 12,
принадлежащих расположенной рядом кристаллической ячейке. Атомы
9, 10, 11, 12
симметричны атомам
5
,
6, 7, 8.
Таким образом, ГЦК решетки координационное число равно 12 (К 12).
В ГПУ решетке при с/а =
1,633 (рис. 3,
в
) атом
А
в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов
1
,
2, 3, 4, 5, 6,
размещенных в вершинах шестигранника, и от трех атомов
7, 8, 9,
расположенных в средней плоскости призмы. Кроме того, атом
А
оказывается на таком же расстоянии еще от трех атомов
10, 11, 12,
принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы
10, 11, 12
симметричны атомам
7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г 12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки (“поры”) 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а “поры” 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
У некоторых металлов кристаллическая решетка может изменяться при изменении температуры. Это явление называется полиморфизмом
или
аллотропией
. Полиморфизм может вызывать изменение свойств.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
1. Кристаллическая структура меди
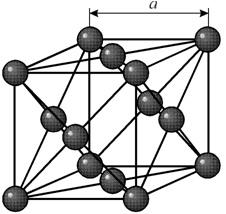
Рис. 1. Крист. структура меди.
1. Из равенства осевых единицa=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число атомов меди в элементарной ячейке 1/8*8+1/2*6=4. 1/8 – доля каждого атома меди, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1/2 – доля каждого атома находящегося в грани элементарной ячейки меди.
3. Атомы меди образуют сложную кубическую гранецентрированную ячейку Бравэ.
4. Поскольку ячейки атомов меди гранецентрированные, в базисе указываются координаты 4-х атомов. [[000;1/2 1/2 0; 1/2 0 1/2;0 1/2 1/2]]. Записывая базис, мы указываем координаты тех атомов, трансляцией которых можно получить всю пространственную решетку.
5. Основные трансляции для атомов меди – 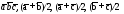 . Перемещая любой из атомов меди (например, расположенный в начале координат) на величины
. Перемещая любой из атомов меди (например, расположенный в начале координат) на величины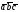 , мы получим все другие атомы меди в пространственной решетке, расположенные в вершинах ячеек.
, мы получим все другие атомы меди в пространственной решетке, расположенные в вершинах ячеек.
6. В структуре меди любой атом, расположенный в вершине ячейки имеет двенадцать ближайших соседей, которыми является атомы, находящиеся в центрах граней. Поэтому КЧ=12.
2. Кристаллическая структура вольфрама.
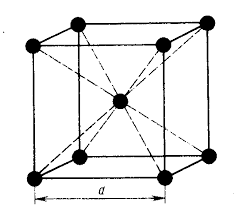
Рис. 2. Крист. структура вольфрама
1. Из равенства осевых единиц a=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число атомов вольфрама в элементарной ячейке, ZW= 1/8 х 8 +1= 2, где 1/8 — доля каждого атома вольфрама, находящегося в вершине, в элементарной ячейке данной структуры; 8 — число такихатомов. 1 атом находится в центре ячейки.
3. Атомы вольфрама образуют сложную кубическую объемноцентрированную ячейку Бравэ.
4. Базисы для атомов вольфрама -[[1/2 1/2 1/2]], [[000]]. Записывая базис, мы указываем координаты того атома, трансляцией которого можно получить всю пространственную решетку.
5. Основные трансляции для атомов вольфрама – 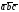 . Перемещая атом, расположенный в начале координат на величины
. Перемещая атом, расположенный в начале координат на величины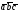 .
.
6. В структуре вольфрама каждый атом окружен восемью атомами, расположенными в вершинах ячейки. КЧ=8.
3. Кристаллическая структура , α-Ti
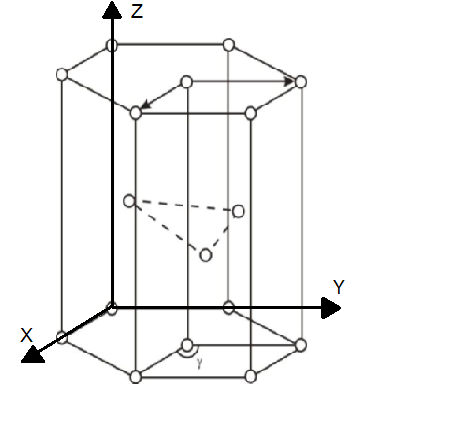
Рис. 3. Крист. структура α-Ti.
1. Из равенства осевых единиц a=b≠c и осевых углов α=β =90°,γ=120 следует, что сингония является гексагональной
2. Определим число атомов α-Ti в элементарной ячейке 1/8*8+1=2. 1/8 – доля каждого атома α-Ti, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1 –атома находящегося внутри элементарной ячейки.
3. Из рис. 4 очевидно, что атомы α-Ti образуют гексагональную компактную плотноупакованная решетку Браве.
4. Базисы для атомов α-Ti -[[2/3 1/3 1/2]], [[000]]. Записывая базис, мы указываем координаты того атома, трансляцией которого можно получить всю пространственную решетку.
5. – 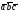 ,222222 . Они присущи примитивной ячейке Браве. Перемещая любой из атомов α-Ti (например, расположенный в начале координат) на величины
,222222 . Они присущи примитивной ячейке Браве. Перемещая любой из атомов α-Ti (например, расположенный в начале координат) на величины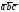 , мы получим все другие атомы в пространственной решетке, расположенные в вершинах ячеек. Также транслируя 2222222 мы получим атомы внутри решетки.
, мы получим все другие атомы в пространственной решетке, расположенные в вершинах ячеек. Также транслируя 2222222 мы получим атомы внутри решетки.
6. В структуре α-Ti каждый атом имеет 12 ближайших соседей атомов поэтому КЧ = 12.
4. Кристаллическая структура NaCl
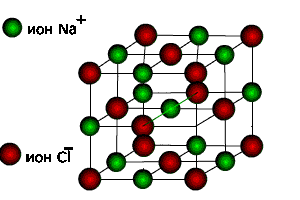
Рис. 4 Крист. структура NaCl.
1. Из равенства осевых единиц a=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число ионов натрия ZNa и хлораZClв элементарной ячейке,ZNa= 1/8 х 4 = 1/2, где 1/8 — доля каждого иона натрия, находящегося в вершине, в элементарной ячейке данной структуры; 4 — число таких ионов.ZCl= 1/8 х 4 = 1/2, где 1/8 — доля каждого иона хлора, находящегося в вершине, в элементарной ячейке данной структуры; 4 — число таких ионов. Число ионов натрия равно числу ионов хлора.
3. Из рис. 4, очевидно, что ионы натрия образуют кубическую гранецентрированную ячейку Браве. Чтобы определить, какую ячейку образует ионы хлора, нужно рассмотреть и соседние ячейки. Выделив в них ионы хлора, нетрудно видеть, что они также образуют гранецентрированную ячейку Браве Р.
4. Запишем базис для ионов натрия и ионов хлора. Поскольку ячейки ионов натрия и хлора примитивные, в базисе указываются координаты двух ионов. Для иона хлора — [[1/2 1/2 1/2]], [[000]]. Для иона натрия — [[1/2 1/2 1/2]], [[000]].
5. Основные трансляции для ионов натрия – 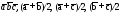 . Для ионов хлора трансляция те же.
. Для ионов хлора трансляция те же.
6. В структуре хлористого натрия каждый ион хлора окружен шестью ионами натрия. Число ближайших ионов хлора к каждому иону натрия также равно шести.. Поэтому КЧNaпо Cl = 6 и КЧСl поNa= 6.
Медь и ее сплавы. · кристаллическая решетка ГЦК (полиморфных превращений не испытывает),



· кристаллическая решетка ГЦК (полиморфных превращений не испытывает),
· высокая тепло- и электропроводность;
· высокие технологические свойства: хорошо обрабатывается давлением, сваривается, легко поддается пайке, полируется.
Различают две основные группы медных сплавов: латуни и бронзы.
9.2.1. Латуни
Латуни – сплавы меди с цинком. Маркируются буквой Л и числом, показывающим содержание меди (например, латунь Л68 содержит 68% Cu и 32% Zn). В марках многокомпонентных латуней содержатся буквенные обозначения элементов, числа последовательно показывают содержание меди и каждого легирующего элемента. Например, латунь ЛАН59-3-2 содержит 59%Cu, 3%Al, 2%Ni (остальное Zn).
В системе Cu–Zn образуются следующие фазы:
· α — твердый раствор цинка в меди, предельная растворимость 39% Zn;
· b′ — упорядоченный твердый раствор меди на основе электронного соединения CuZn, существует при температуре ниже 454°С;
· b — неупорядоченный твердый раствор меди на основе CuZn, существует при температуре выше 454°С.
Практическое применение имеют латуни, содержащие до 45% Zn, сплавы с большей концентрацией цинка обладают пониженной прочностью и пластичностью.
Латуни по структуре делят на две группы:
· однофазные со структурой α-твердого раствора, содержат
9.2.2. Бронзы
Бронзы – это сплавы меди с различными элементами: оловом, алюминием, кремнием, хромом, кадмием, бериллием и др. Маркировка бронз начинается с букв Бр, далее следуют буквенные обозначения легирующих элементов, а затем цифры, показывающие содержание каждого элемента. Например, бронза БрОЦС6-6-3 содержит 6%Sn, 6%Zn, 3%Pb, остальное – медь.
9.2.2.1. Оловянные бронзы
В системе Cu–Sn образуются следующие фазы:
· α-твердый раствор олова в меди;
· химические соединения Cu5Sn (β-фаза), Cu3Sn (ε-фаза), Cu31Sn8 (δ-фаза).
Практическое значение имеют сплавы, содержащие до 10…12%Sn. По содержанию олова бронзы делят на:
- деформируемые, с содержанием Sn до 6%;
- литейные, с содержанием Sn более 6%.
Деформируемые бронзы (БрО5) имеют однофазную структуру α-твердого раствора. Упрочняются холодной пластической деформацией, применяются в виде прутков, лент и проволоки. В отожженном состоянии они обладают высокими упругими свойствами и сопротивлением усталости, поэтому их используют для изготовления пружин, в электротехнике, химическом машиностроении и др.
Литейные бронзы (БрО10), имеют двухфазную структуру α–твердого раствора с включениями Cu31Sn8, что обеспечивает им высокие антифрикционные свойства. Применяются литейные бронзы для подшипников скольжения ответственного назначения.

Оловянные бронзы дополнительно легируют элементами: Zn, Pb, Ni, P.
Для экономии более дорогостоящего олова в бронзы добавляют 2…15%Zn. Цинк улучшает жидкотекучесть, плотность отливок, повышает механические свойства, способность к сварке и пайке (БрОЦ4-3).
Свинец повышает антифрикционные свойства и улучшает обрабатываемость резанием (БрОЦС4-4-2,5).
Фосфор повышает жидкотекучесть, упругие и антифрикционные свойства (БрОФ6,5-0,4).
Никель способствует измельчению структуры и повышению механических и коррозионных свойств (БрОЦСН3-7-5-1).
9.2.2.2 Алюминиевые бронзы
(БрА5, БрАЖ9-4) применяют для изготовления высокоответственных деталей типа шестерен, втулок, фланцев.
9.2.2.3. Кремнистые бронзы
(БрК4, БрКМц3-1) превосходят оловянные бронзы по коррозионной стойкости и механическим свойствам, имеют высокие упругие свойства.
9.2.2.4. Свинцовые бронзы
(БрС30) используют как антифрикционный материал для ответственных высоконагруженных подшипников.
9.2.2.5. Бериллиевую бронзу
(БрБ2) применяют для изготовления упругих элементов точных приборов (пружин, мембран). Эти сплавы упрочняются термообработкой, состоящей из закалки и старения. Упрочнение достигается за счет образования a-раствора с частицами интерметаллидной g-фазы (CuBe).
Железо: микроструктура и кристаллическая решетка
Виды кристаллических решёток
В действительности чёткую структуру имеют все вещества, пребывающие в твёрдом состоянии. Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры). Такие структуры называются кристаллическими решётками. Места, в которых находятся сами молекулы, ионы или атомы, называют узлами. А расстояния между узлами получили название – периоды идентичности. В зависимости от положения частиц в пространстве, различают несколько типов:
- атомная;
- ионная;
- молекулярная;
- металлическая.
В жидком и газообразном состоянии вещества не имеют чёткой решётки, их молекулы движутся хаотично, именно поэтому они не имеют формы. Например, кислород, находясь в газообразном состоянии, представляет собой бесцветный газ без запаха, в жидком (при -194 градусов) – раствор голубоватого цвета. Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
Интересно, что у аморфных веществ нет чёткой структуры, поэтому у них и нет строгой температуры плавления и кипения. Смола и пластилин при нагревании постепенно размягчаются и становятся жидкими, у них нет чёткой фазы перехода.





Значение знаний о кристаллическом строении металлов
Из вышеизложенного материала очевидно, что знания о тонкой структуре и строении позволяют спрогнозировать свойства материала и повлиять на них. И это позволяет делать наука химия. 9 класс общеобразовательной школы делает в процессе обучения упор на то, чтобы сформировать у учащихся четкое понятие о важном значении основополагающей логической цепочки: состав — строение — свойства — применение.
Сведения о кристаллическом строении металлов очень четко иллюстрирует эту зависимость и позволяет учителю наглядно объяснить и показать детям, насколько важно знать тонкую структуру, чтобы правильно и грамотно использовать все свойства.
Атомная кристаллическая решётка
В узлах находятся атомы, о чём и говорит название. Эти вещества очень крепкие и прочные, так как между частицами образуется ковалентная связь. Соседние атомы образуют между собой общую пару электронов (а, точнее, их электронные облака наслаиваются друг на друга), и поэтому они очень хорошо связаны друг с другом. Самый наглядные пример – алмаз, который по шкале Мооса обладит наибольшей твёрдостью. Интересно, что алмаз, как и графит, состоит из углевода. Графит является очень хрупким веществом (твёрдость по шкале Мооса – 1), что является наглядным примером того, как много зависит от вида.
Атомная кр. решётка плохо распространена в природе, к ней относятся: кварц, бор, песок, кремний, оксид кремния (IV), германий, горный хрусталь. Для этих веществ характерна высокая температура плавления, прочность, а также эти соединения очень твёрдые и нерастворимые в воде. Из-за очень сильной связи между атомами, эти химические соединения почти не взаимодействуют с другими и очень плохо проводят ток.
Общее понятие о металлах
«Химия. 9 класс» — это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.

Ионная кристаллическая решётка
В этом типе ионы располагаются в каждом узле. Соответственно, этот вид характерен для веществ с ионной связью, например: хлорид калия, сульфат кальция, хлорид меди, фосфат серебра, гидроксид меди и так далее. К веществам с такой схемой соединения частиц относятся;
- соли;
- гидроксиды металлов;
- оксиды металлов.
Хлорид натрия имеет чередование положительных (Na +) и отрицательных (Cl -) ионов. Один ион хлора, находящийся в узле, притягивает к себе два иона натрия (благодаря электромагнитному полю), которые находятся в соседних узлах. Таким образом, образуется куб, в котором частицы связаны между собой.
Для ионной решётки характерна прочность, тугоплавкость, устойчивость, твёрдость и нелетучесть. Некоторые вещества могут проводить электрический ток.
Вентиляционные решетки
Решетка вентиляционная металлическая 170х240
Вентиляционные решетки предназначены для декоративного оформления выходов приточных или вытяжных систем жилых, общественных и промышленных зданий. Помимо декоративных функций, они распределяют и рассеивают воздух, являясь важным элементом системы воздухообмена.
Стальные вентиляционные решетки – качество и надежность!
Основные материалы, используемые при производстве вентиляционных решеток: пластик, алюминий и листовая сталь. уже более 20 лет производит вентиляционные решетки. По нашему мнению, лучший материал для изготовления решеток – прочная листовая сталь. Изделия «ДОМАРТ» выполнены из холоднокатаной стали толщиной 0,5 мм.
Характеристики
Долговечность.
Модели из стали по сравнению с решетками из прочих материалов обладают лучшими эксплуатационными характеристиками. Применение полимерного покрытия увеличивает срок службы изделий и позволяет предотвратить их коррозию.
Безопасность.
Решетки из металла пожаробезопасны, хорошо противостоят воздействию паров кислот и других агрессивных веществ. Кроме этого, сталь не содержит летучих химических соединений, неблагоприятно влияющих на самочувствие жильцов дома. В этом стальные вентиляционные решетки имеют весомое преимущество по сравнению с ПВХ-решетками.
Доступная цена.
Изделия изготавливаются из холоднокатаной листовой стали методом штамповки. Оптимальный выбор материала обеспечивает невысокую стоимость наших изделий: цена стальных вентиляционных решеток значительно ниже, чем у аналогичных изделий, изготовленных из алюминия.
Решетки, представленные в данном разделе, поставляются без индивидуальной упаковки. Вся необходимая для торговли информация о товаре представлена на стикере-наклейке, которая крепится непосредственно на изделие. Если вас интересуют вентиляционные решетки в индивидуальной фирменной упаковке под вывеску, вы можете приобрести наши решетки с антимоскитной сеткой.
Вентиляционные решетки можно приобрести онлайн!
Купить металлические вентиляционные решетки можно в режиме онлайн. Наш онлайн-магазин работает 24 часа в сутки. Специалисты могут ответить на ваши вопросы по телефону или электронной почте ежедневно с 8:00 до 17:00. Отгрузка товара производится ежедневно с понедельника по пятницу (кроме праздничных дней).
Вентиляционные решетки
У нас Вы можете купить решетки вентиляционные металлические по ценам производителя. Широкий ассортимент, выгодные условия сотрудничества, доставка в разные регионы России.
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).
Какие из металлических изделий предпочтительней
Практика показывает, что чаще выбор падает на решетки из алюминия и оцинкованной стали. Стальные хоть и менее долговечные и более тяжелые, чем алюминиевые детали, но при этом более прочные, поскольку но выдерживают большие механические нагрузки. Справедливости ради стоит отметить, что алюминиевые изделия проще устанавливать и они, в сравнении со стальными, дольше не подвергаются коррозии.
Нержавеющая сталь могла бы стать идеальным вариантом для решеток наружного применения, но стоимость их очень высока, и потому, встречаются в продаже они довольно редко. Также редко применяют конструкции медные, латунные или бронзовые. Они очень красивы, но дороги и потому их иногда используют для декорирования вентиляционных отверстий внутри помещения владельцы частных домов.
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Свойства металлов
К специфическим свойствам рассматриваемых веществ относят следующие.
- Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
- Ковкость и пластичность — способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
- Электропроводность и теплопроводность — одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.



