Какая степень окисления у железа?
№26 Железо
История открытия:
Железо известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Латинское ferrum, скорее всего, заимствовано из какого-то восточного языка, скорее всего из финикийского.
Нахождение в природе и получение:
Железо — один из самых распространённых элементов на Земле и вообще в Солнечной системе. Металлическое железо в образует ядро Земли, где его содержание, по оценкам, около 90%. Содержание железа в земной коре составляет 5 %, тем не менее и здесь из металлов железо уступает по распространённости только алюминию. Из минералов наибольшее практическое значение имеют красный железняк (гематит, Fe2O3), магнитный железняк (магнетит, Fe3O4), бурый железняк или лимонит (FeOOH и FeOOH·nH2O). Пирит FeS2 (серный или железный колчедан) используется в производстве серной кислоты.
Наиболее распространённым промышленным способом получения железа является доменный процесс, в основе которого восстановление оксидом углерода(II): Fe2O3 + 3CO = 2Fe + 3CO2↑
При этом получается железо, содержащее до 7% углерода и другие примеси — чугун. Чугун в дальнейшем перерабатывают в более чистое железо — сталь, удаляя примеси окислением в мартеновских печах или конвертерах. Сталь может быть легирована добавками других металлов, для повышения ее прочности, корозионной стойкости и т.п.
Используется также прямой способ получения железа, в котором железные окатыши при 1000 o С восстанавливают водородом, получаемым при конверсии метана: Fe2O3 + 3H2 = 2Fe + 3H2O↑
Физические свойства:
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, ковок, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Tпл=1812K, Tкип=3134K.
Химические свойства:
Железо относится к металлам средней активности, в ряду напряжений стоит до водорода и растворяется во многих кислотах, но концентрированной серной и азотной кислотами пассивируется и на холоду с ними не реагирует. Раскаленное железо реагирует с водяным паром: 3Fe + 4H2O = Fe3O4 + 4H2↑ (раньше так получали водород для наполнения аэростатов).
При нагревании железо реагирует со многими неметаллами, часто образуя соединения нестехиометрического состава карбиды, бориды, силициды, нитриды и др.
Наиболее характерными для железа являются степени окисления +2 и +3, известны также соединения, где железо имеет степень окисления +6.
Важнейшие соединения:
Степень окисления +2 — основный оксид FeO (чёрный), гидроксид Fe(OH)2 (зеленый). Соли железа(II) (бледно-зеленого цвета), образуют кристаллогидраты (напр. железный купорос, FeSO4*7H2O), легко окисляются кислородом до соединений железа(III).
Степень окисления +3 — наиболее устойчивая степень окисления железа, ей соответствуют: оксид Fe2O3 и гидроксид Fe(OH)3 (оба — коричневого цвета), соли железа(III) — (образуют кристаллогидраты, в растворах сильно гидролизованы). Т.к. оксид железа(III) проявляет слабые основные свойства, он частично растворим в конц. щелочах, а при сплавлении со щелочами образует соотв. соли — ферриты: Fe2O3 + 2NaOH = 2NaFeO2 + H2O↑
При растворении ферриты нацело гидролизуются.
Смешаный оксид, Fe3O4 или FeO*Fe2O3, («железная окалина») можно рассматривать также как феррит железа(II): Fe(FeO2)2. При взаимодействии его с растворами кислот образуется смесь солей железа (II) и (III).
Для железа в степени окисления +2 и +3 характерно образование многочисленных комплексных соединений, например таких как гексацианоферрат(II) калия K4[Fe(CN)6] («желтая кровяная соль») и гексацианоферрат(III) калия K3[Fe(CN)6] («красная кровяная соль»). При взаимодействии ионов Fe 3+ и [Fe(CN)6] 4- выпадает ярко-синий осадок гексацианоферрата(II) калия-железа(III) (берлинская лазурь): FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl. Это качественная реакция для обнаружения ионов Fe 3+ . Аналогичная реакция используется для открытия ионов железа(II): FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + 2KCl; («турнбулева синь»).
Степень окисления +6 — Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Ферраты — сильные окислители. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи: 2Fe(OH)3 + 3Cl2 + 10KOH = 2K2FeO4 + 6KCl + 8H2O
Применение
— Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
— Железо может входить в состав сплавов на основе других металлов — например, никелевых.
— Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Биологическая роль и физиологическое действие
Железо входит в состав гемоглобина крови, обеспечивая, за счет своих окислительно-восстановительных свойств, ее важнейшую функцию, транспорт кислорода в ткани организма. В крови взрослого человека содержится около 4 г железа, его недостаток приводит к заболеванию железодефицитной анемией. Восполнить недостаток железа можно за счет пищевых продуктов, содержащих железо в хорошо усвояемой форме (печень, мясо, бобовые) или медикаментов.
Избыточное накопление железа в организме оказывает токсическое действие. ПДК железа в воде 0,3 мг/л.
Аксенова Ирина, Пуртова Ксения, ТюмГУ, 502(1) группа, 2013 г.
V. Характерные степени окисления железа.
I. Строение атома.

Fe +2 , Fe +3 — основные степени окисления
Fe +6 —очень редко, в солях железной кислоты (K2FeO4)
II. Физические свойства.
Fe —металл серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Железо относится к умеренно тугоплавким металлам. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
III. Химические свойства.
Железо относится к металлам средней активности.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
1. Взаимодействие с кислородом.
Железо горит в кислороде, нагретое горит на воздухе.
| 150 — 600°C |
| t |
Пропускание кислорода или воздуха через расплавленное железо:
| t |
2. Взаимодействие с серой.
3. Взаимодействие с углеродом.
Fe + C → Fe3C (карбид железа)
4. Взаимодействие с азотом.
| t |
Fe + N2 → Fe3N ( нитрид железа)
5. Взаимодействие с хлором.
| t |
2Fe + 3Cl2 → 2FeCl3 (хлорид железа)
| t |
6. Взаимодействие раскалённого железа с водяным паром:
7. Взаимодействие с кислотами.
8. Особенности взаимодействия железа с концентрированными H2SO4 и HNO3.
| t |
Fe + H2SO4 (конц)→ пассивирует
Fe + HNO3 (конц)→ пассивирует
С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
9. Взаимодействие с растворами солей — железо способно восстанавливать металлы, стоящие в ряду активности правее него.
10. Железо восстанавливает соединения железа (III):
11. Железо, при повышенном давлении, реагирует с несолеобразующим оксидом – СО с образованием веществ сложного состава – карбонилов — Fe(CO)5, Fe2(CO)9 и Fe3(CO)12.
IV. Получение железа
Основной способ получения железа – из железной руды (гематит (Fe2O3) , магнетит (FeO·Fe2O3)) или электролиз растворов его солей (в этом случае получают «чистое» железо, т.е. железо без примесей).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Химизм доменного процесса следующий:
FeO + CO = Fe + CO2.
V. Характерные степени окисления железа.
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
| +2 | FeO | Fe(OH)2 | Слабоосновный | Слабый восстановитель |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | Слабый окислитель |
| +6 | Не получен | * | Кислотный | Сильный окислитель |
* Кислота в свободном виде не существует — получены только её соли.
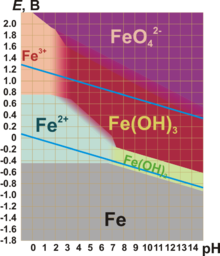
Для железа характерны степени окисления — +2 и +3.
Соединения Fe +2 .
FeO — основный оксид черного цвета, в воде не растворим, растворим в к кислотах, бурый железняк.
При взаимодействии с водородом при температуре 350 о С и коксом при температуре выше 1000 о С восстанавливается до чистого железа.
Получают оксид железа (II) разными способами:
1. В результате реакции восстановления оксида трёхвалентного железа угарным газом.
2. Нагревая железо при низком давлении кислорода
3. Разлагая оксалат двухвалентного железа в вакууме
4. Взаимодействием железа с оксидами железа при температуре 900-1000 о
Fe(OH)2 — кристаллическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде. При нагревании разлагается.
1. Взаимодействие с кислотами.
2. При нагревании реагирует с концентрированными растворами солей аммония
| 150 — 200°C |
3. При нагревании разлагается.
4. Fe(OH)2 не устойчив, легко окисляется.
Получение Fe(OH)2.
1. В виде осадка в обменных реакциях растворов солей железа(II) со щёлочью
2. Образование гидроксида железа(II) является одной из стадий ржавления железа:
Качественные реакции на Fe +2
1. Pеакция с красной кровяной солью (гексацианоферрат калия K3[Fe(CN)6]).
турнбуллева синь(гексацианоферрат (II) железа (III) — калия)
Появление турнбуллевой сини доказывает присутствие в растворе ионов железа (II).
2. Pеакция со щелочью.
Соединения Fe +3 .
Fe2O3— оксид, проявляющий слабоамфотерные свойства, порошок бурого цвета, в воде не растворим. В природе встречается как минерал гематит.
Fe2O3 имеет и другие названия: окись железа, железный сурик, крокус, пигмент красный 101, пищевой краситель E172.
Может взаимодействовать как с кислотами, так и со щелочами.
1. Взаимодействие с кислотами.
2. Взаимодействие со щелочами.
3. Взаимодействие с солями щелочных металлов.
4. При температуре выше 1400°С разлагается:
1. Термическое разложение гидроксида железа (III)
2. Окисление пирита
Fe(OH)3 — образуется в виде осадка, называемым ржавчиной коричнево-бурого цвета, слабоамфотерный гидроксид с преобладанием основных свойств. В воде нерастворим. Легко образует коллоидные растворы.
1. Взаимодействие с кислотами.
2. Взаимодействие с концентрированными растворами щелочей.
гексагидроксоферрат (III) натрия
При сплавлении со щелочами или щелочными реагентами образует ферриты:
3. При нагревании разлагается:
Получение Fe(OH)3.
Соли железа (III).
Железо (III) образует соли практически со многими анионами.
В растворе соли железа (III) значительно более устойчивы, чем соли железа (II). Растворы солей имеют желто-бурую окраску и, вследствие гидролиза, кислую среду:
Fe 3+ + H2O = FeOH 2+ + H + .
Соли железа (III) гидролизуют в большей степени, чем соли железа (II), по этой причине соли железа (III) и слабых кислот нельзя выделить из раствора, они мгновенно гидролизуют с образованием гидроксида железа (III):
Проявляют все свойства солей.
Обладают преимущественно окислительными свойствами:
Качественные реакции на Fe 3+
1. Взаимодействие с гексацианоферратом (II) калия (желтой кровяной солью) :
осадок синего цвета
берлинская лазурь (гексацианоферрат (III) железа (II) — калия)
2. Взаимодействие солей железа (III) с роданидом калия или аммония:
Но стоит только к кроваво-красному раствору роданида железа добавить раствор фторида натрия, как он становится совершенно бесцветным. Образуется очень прочный комплексный ион [FeF6] 3- , при этом роданидный комплекс разрушается:
Реакция со щелочью.
В природе встречается как минерал магнетит, или магнитный железняк. Он является хорошим проводником электрического тока и обладает магнитными свойствами. Образуется при горении железа и при действии перегретого пара на железо.
1. Нагревание при температуре 1538 о С приводит к его распаду
2. Вступает в реакцию с кислотами
3. Со щелочами реагирует при сплавлении
4. Вступает в реакцию с кислородом воздуха
5. Восстановление происходит при реакции с водородом и монооксидом углерода
Соединения Fe +6 .
H2FeO4 в свободном состоянии не существует.
Хром, железо и медь
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.

В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
-
Реакции с неметаллами
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.

Протекает в раскаленном состоянии.
Реакции с кислотами

С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Реакции с солями менее активных металлов
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III), реагирует с кислотами, кислотными оксидами.

Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )

Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂

В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит

Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

-
Реакции с неметаллами
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t 2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.

Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.

И еще одна качественная реакция на ионы Fe 3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.

Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит

Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
-
Реакции с неметаллами
Во влажном воздухе окисляется с образованием основного карбоната меди.
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Реакции с кислотами
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.

Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
С оксидами неметаллов
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Оксид меди (I) окисляется кислородом до оксида меди (II).
Оксид меди (I) вступает в реакции с кислотами.
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
-
Реакции с кислотами
CuO + CO = Cu + CO2
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.

При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Реакции с кислотами
Реакции с щелочами
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Реакции с кислотными оксидами
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Степени окисления элементов. Как найти степени окисления?
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
| Элемент | Характерная степень окисления | Исключения |
| H | +1 | Гидриды металлов: LIH -1 |
| F | -1 | F 2 |
| O | -2 | F 2 O +2 ; пероксиды, надпероксиды, озониды |
| Li, Na, K, Rb, Cs, Fr | +1 |   |
| Be, Mg, Ca, Sr, Ba, Ra | +2 |   |
| Al | +3 |   |
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3 ).
Решение . Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х — искомая степень окисления. Составляем простейшее уравнение: х + 3 • (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 • (+1) + х + 4 • (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .
Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3 ) 3 .
Решение . Алгоритм остается неизменным. В состав «молекулы» нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 • (+3) + 3х + 9 • (-2) = 0. Ответ: Al +3 (N +5 O -2 3 ) 3 .
Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4 ) 3- .
Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 • (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5 . Определите степени окисления всех элементов в (NH 4 ) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота — нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую «молекулу», а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1 ) 2 S +6 O 4 -2 .
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Пример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH.
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность — нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую «экзотику» здесь обсуждать не будем);
- степень окисления — формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие «валентность», наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Какая степень окисления у железа?













Последнее обновление
4 апреля 2020г.
Валентность —
— это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления
– это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
фтор высшая степень окисления ноль в простом веществе F2 0
кислород высшая степень окисления +2 во фториде кислорода О +2 F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст.ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.) , в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са 0 , O2 0 , Cl2 0
II. ст.ок. в бинарных c оединениях:
Менее электроотрицательный элемент ставится на первое место. ( Исключения: С -4 Н4 + метан и N -3 H 3 + аммиак)
Нужно помнить, что
— ст.ок. металла всегда положительна
— ст.ок. металлов I , II , III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст.ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст.ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2 +1 О2 -1 , Ba +2 O 2 -1 и др. ; карбиды металлов I и II групп Ag 2 +1 C 2 -1 , Ca +2 C 2 -1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe +2 S2 -1 ). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, — S — S- , тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV , у кислорода и серы II .
III. Степень окисления в основаниях Ме + n (ОН) n равна количеству гидроксогрупп .
1. в гидроксогруппе ст.ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст.ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст.ок. водорода +1, кислорода -2
2. ст.ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
х = +5 (не забудьте знак +)
Можно запомнить , что у кислот с высшей ст.ок. центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н N О3 азотная Н N +5 О3
НС l О4 хлорная Н Cl +7 О4
Н Mn О4 марганцовая Н Mn +7 О4
Останется запомнить:
Н N О2 азотистая Н N +3 О2
НС l О3 хлорноватая Н Cl +5 О3
НС l О2 хлористая Н Cl +3 О2
НС l О хлорноватистая Н Cl +1 О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст.ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH 4 + Cl — : записываем ион N х Н4 +1
Наприме р, определить ст.ок. элементов в гексацианоферрате( III ) калия К3[ Fe ( CN )6]
— у калия +1 : К3 +1 [ Fe ( CN )6], отсюда заряд иона [ Fe ( CN )6] 3-
— у железа +3 (указано в названии) [ Fe +3 ( CN )6] 3- , отсюда ( CN )6 6-
— у одной группы ( CN ) —
— более электроотрицательный азот: у него -3, отсюда ( C х N -3 ) —
ст.ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст.ок. водорода равна +1, кислорода -2
ст.ок. углерода -2 (при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте H3PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
