Какой тип кристаллической решетки характерен для меди?
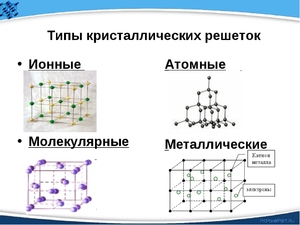
Типы кристаллических решёток
Урок 9. Химия 11 класс ФГОС

В данный момент вы не можете посмотреть или раздать видеоурок ученикам в личном кабинете
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно его приобрести.
Получите невероятные возможности



Конспект урока «Типы кристаллических решёток»
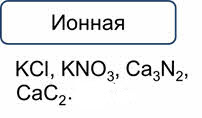
Для определения типа кристаллической решётки поступают следующим образом. Если связь в соединении ионная, то кристаллическая решётка всегда ионного типа: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.
Если связь металлическая, то и кристаллическая решётка всегда металлическая: латунь, железо, медь, натрий.

Если связь ковалентная, то решётка может быть, как атомной, так и молекулярной. Веществами с атомной кристаллической решёткой являются: карборунд, оксид кремния четыре, бор, кремний, алмаз, графит, чёрный и красный фосфор.

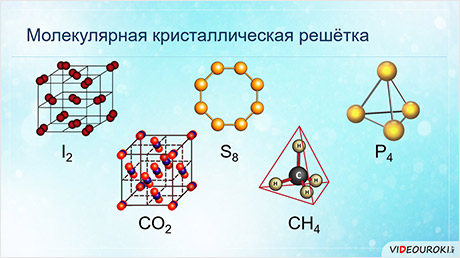
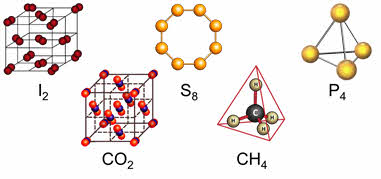
У веществ с молекулярной кристаллической решёткой в узлах кристаллической решётки расположены молекулы, прочность данной связи слабая.
Для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, то есть они легкоплавки и летучи, значительная сжимаемость, иногда запах, а также явление сублимации, или возгонки, как для йода и твёрдого углекислого газа.
Для веществ с молекулярной кристаллической решёткой характерна небольшая твёрдость, большинство этих веществ хорошо растворимы в воде. Молекулярную кристаллическую решётку имеют газы и жидкости в твёрдом агрегатном состоянии. Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.
У веществ с атомной кристаллической решёткой в узлах расположены атомы. Связь между атомами в кристаллические решётки – ковалентная, очень прочная. Для этих веществ характерны высокие температуры кипения и плавления, то есть они тугоплавки и нелетучий, очень твёрдые, практически не растворимы в воде и не имеют запаха.
Примером веществ с таким типом кристаллических решёток являются алмаз и графит.
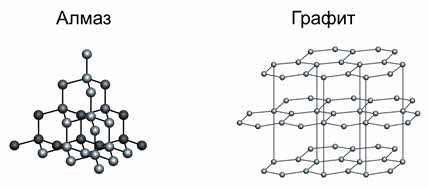
Как известно, твёрдость алмаза оценивается по шкале Мооса самым высоким значением – 10. Благодаря высокой твёрдости алмаз используют для изготовления буров, свёрл, шлифовальных инструментов, стеклорезов. Алмаз является камнем ювелиров, они используют отшлифованные алмазы – бриллианты.
Графит также является веществом с атомной кристаллической решёткой, но несмотря на это, он мягкий, так как имеет слоистую структуру. В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники. Связи между слоями непрочные, за счёт этого графит мягкий. Графит, как и алмаз, тугоплавкий. Из него изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия. Такие, как наждак, корунд, рубин, сапфир.

Наиболее распространённое соединение кремния – это оксид кремния четыре, который также имеет атомную кристаллическую решётку. Почти чистым оксидом кремния четыре является минерал кварц.

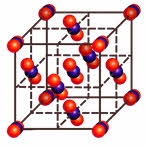
У веществ с ионным типом связи в узлах кристаллической решётки расположены ионы, связь между частицами – ионная, она прочная.
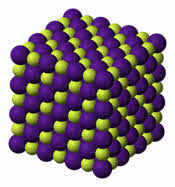
Для веществ с ионным типом связи характерны следующие свойства: высокие температуры плавления и кипения, они тугоплавки и нелетучи, они твёрдые, хрупкие, многие растворимы в воде. Их хрупкость объясняется тем, что если попробовать деформировать такую кристаллическую решётку, то один из её слоёв будет двигаться относительно другого слоя до тех пор, пока одинаково заряженные ионы не будут друг против друга. Эти ионы начнут отталкиваться друг от друга, и кристаллическая решётка разрушиться.
Вещества с ионным типом связи плохо проводят электрический ток и тепло. Но их растворы и расплавы проводят электрический ток. Вещества с ионным типом связи не имеют запаха.
Ионное соединение представляет собой гигантскую ассоциацию ионов, расположенных в пространстве благодаря равновесию сил притяжения и отталкивания.
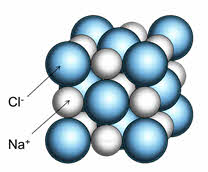
Например, кристалл хлорида натрия состоит из катионов натрия и анионов хлора. Каждый катион натрия окружён шестью анионами хлора, а каждый анион хлора – шестью катионами натрия. Наименьшей структурной единицей кристалла является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
У веществ с металлическим типом связи в узлах кристаллической решётки расположены атом-ионы, связь между ними металлическая. Связь может быть различной по прочности.
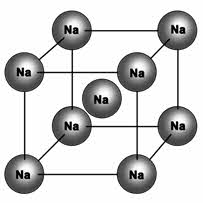
Металлическая кристаллическая решётка определяет свойства металлов: ковкость, пластичность, электро-и теплопроводность, металлический блеск, способность образовывать сплавы.
Пластичность выражается в способности металлов деформироваться под действием механической нагрузки. Это свойство лежит в основе ковки, прокатки металлов, их способности вытягиваться в проволоку. Пластичность объясняется тем, что под воздействием силы слои перемещаются относительно друг друга без разрыва связи между ними.
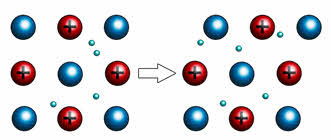
Например, если двумя плоскими стеклянными пластинками поместить несколько капель воды, то пластинки будут свободно скользить относительно друг друга, но вот разъединить их будет достаточно сложно. Таким образом, в данном опыте вода играла роль свободных электронов, которые находятся в металлической кристаллической решётке.
Наиболее пластичными металлами являются золото, серебро и медь. Именно из золота можно сделать самую тонкую фольгу толщиной три тысячных миллиметра. Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Высокая электропроводность металлов обусловлена наличием свободных электронов, которые под действием электрического тока приобретают направленное движение.
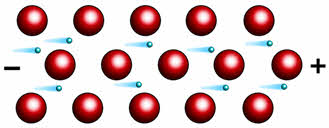
Лучшими проводниками электрического ока являются серебро и медь, немного худшим – алюминий. Однако в большинстве случаев в качестве электропроводов используют алюминий, а не медь.
Теплопроводность металлов также объясняется движением свободных электронов, которые сталкиваются с атом-ионами в узлах кристаллической решётки и обмениваются с ними энергией. Благодаря этому свойству металлическая посуда равномерно нагревается.
Вещества с металлическим типом кристаллической решётки имеют металлический блеск из-за отражения световых лучей.
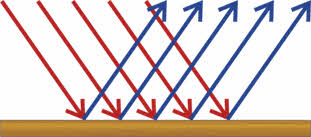
Высокой светоотражающей способностью обладают ртуть, серебро, палладий и алюминий. Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.

Большинство металлов имеет серебристо-белый цвет. Только золото окрашено в жёлтый цвет, а медь в красный.
Металлическая кристаллическая решётка характерна не только для металлов, но и для сплавов. Это отличает металлические сплавы от других сплавов: стекла, фарфора, керамики, базальтов, гранитов, гнейсов.
1.Металлы. Строение и свойства металлов. Металлическая связь. Типы кристаллических решёток металлов. Полиморфизм и анизотропия.
Объемно-центрированная кубическая (ОЦК) (2 атома на ячейку), б)
Гранецентрированная кубическая (ГЦК) (4 атома на ячейку), в)
Гексагональная плотноупакованная (ГП) (6 атомов на ячейку), г)
Рис. 2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 2, б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряется в нанометрах (1 нм = 10 -9 м =10 A). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра – сторону шестигранника а и высоту призмы с. Когда отношение с/а =1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 1, г). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357-0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.

Рис. 3. Координационное число в различных кристаллических решетках для атома А: а) – объемноцентрированная кубическая (К 8); б) – гранецентрированная кубическая (К 12); в) – гексагональная плотноупакованная (Г 12)
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
В ОЦК решетке (рис. 3, а
) атом
А
(в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К 8).
В ГЦК решетке (рис. 3, б)
атом
А
(на грани куба) находится на наиболее близком равном расстоянии от четырех атомов
1
,
2, 3, 4,
расположенных в вершинах куба, от четырех атомов
5, 6, 7, 8,
расположенных на гранях куба, и, кроме того, от четырех атомов
9, 10, 11, 12,
принадлежащих расположенной рядом кристаллической ячейке. Атомы
9, 10, 11, 12
симметричны атомам
5
,
6, 7, 8.
Таким образом, ГЦК решетки координационное число равно 12 (К 12).
В ГПУ решетке при с/а =
1,633 (рис. 3,
в
) атом
А
в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов
1
,
2, 3, 4, 5, 6,
размещенных в вершинах шестигранника, и от трех атомов
7, 8, 9,
расположенных в средней плоскости призмы. Кроме того, атом
А
оказывается на таком же расстоянии еще от трех атомов
10, 11, 12,
принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы
10, 11, 12
симметричны атомам
7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г 12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки (“поры”) 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а “поры” 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
У некоторых металлов кристаллическая решетка может изменяться при изменении температуры. Это явление называется полиморфизмом
или
аллотропией
. Полиморфизм может вызывать изменение свойств.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Атомная, молекулярная, ионная и металлическая кристаллическая решётка
Согласно атомно-молекулярной теории Бойля, все вещества состоят из молекул, которые находятся в постоянном движении. Но существует ли какая-то определённая структура в веществах? Или они просто состоят из хаотично движущихся молекул?
Виды кристаллических решёток
В действительности чёткую структуру имеют все вещества, пребывающие в твёрдом состоянии. Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры). Такие структуры называются кристаллическими решётками. Места, в которых находятся сами молекулы, ионы или атомы, называют узлами. А расстояния между узлами получили название – периоды идентичности. В зависимости от положения частиц в пространстве, различают несколько типов:
- атомная;
- ионная;
- молекулярная;
- металлическая.
В жидком и газообразном состоянии вещества не имеют чёткой решётки, их молекулы движутся хаотично, именно поэтому они не имеют формы. Например, кислород, находясь в газообразном состоянии, представляет собой бесцветный газ без запаха, в жидком (при -194 градусов) – раствор голубоватого цвета. Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
Интересно, что у аморфных веществ нет чёткой структуры, поэтому у них и нет строгой температуры плавления и кипения. Смола и пластилин при нагревании постепенно размягчаются и становятся жидкими, у них нет чёткой фазы перехода.
Атомная кристаллическая решётка
В узлах находятся атомы, о чём и говорит название. Эти вещества очень крепкие и прочные, так как между частицами образуется ковалентная связь. Соседние атомы образуют между собой общую пару электронов (а, точнее, их электронные облака наслаиваются друг на друга), и поэтому они очень хорошо связаны друг с другом. Самый наглядные пример – алмаз, который по шкале Мооса обладит наибольшей твёрдостью. Интересно, что алмаз, как и графит, состоит из углевода. Графит является очень хрупким веществом (твёрдость по шкале Мооса – 1), что является наглядным примером того, как много зависит от вида.
Атомная кр. решётка плохо распространена в природе, к ней относятся: кварц, бор, песок, кремний, оксид кремния (IV), германий, горный хрусталь. Для этих веществ характерна высокая температура плавления, прочность, а также эти соединения очень твёрдые и нерастворимые в воде. Из-за очень сильной связи между атомами, эти химические соединения почти не взаимодействуют с другими и очень плохо проводят ток.

Ионная кристаллическая решётка
В этом типе ионы располагаются в каждом узле. Соответственно, этот вид характерен для веществ с ионной связью, например: хлорид калия, сульфат кальция, хлорид меди, фосфат серебра, гидроксид меди и так далее. К веществам с такой схемой соединения частиц относятся;
- соли;
- гидроксиды металлов;
- оксиды металлов.
Хлорид натрия имеет чередование положительных (Na + ) и отрицательных (Cl — ) ионов. Один ион хлора, находящийся в узле, притягивает к себе два иона натрия (благодаря электромагнитному полю), которые находятся в соседних узлах. Таким образом, образуется куб, в котором частицы связаны между собой.
Для ионной решётки характерна прочность, тугоплавкость, устойчивость, твёрдость и нелетучесть. Некоторые вещества могут проводить электрический ток.
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Видео
Дополнительную информацию о кристаллических решетках вы найдете в нашем видео.
Химическая связь. Часть 2. Типы кристаллических решеток

-
Опубликовано 31.08.2020Образование
Химическая связь. Часть 2. Типы кристаллических решеток
Продолжаем нашу тему по химической связи и сегодня изучаем кристаллическое состояние вещества, понятия ионная связь, металлическая связь из 4 задания егэ по химии.
Итак, для понимания материала давайте возьмем с вами стакан с плоским дном и насыплем в него бусины (пусть они будут круглые) в один слой. У нас получился моноатомный слой. Кстати пусть одна бусина отличается по цвету от других. Назовем ее центральной.
Рассмотрим наше построение и сделаем первые выводы:
- Любая бусина окружена шестью другими (пусть они будут под цифрами 1-6)
- Поверхность слоя имеет неровности, возвышения и впадины. Каждая бусина – это возвышенность, между тремя любыми соприкасающимися бусинами – впадина.
- Расположение бусин в слое можно представить в виде сетки из перекрёстных линий, а в точках пересечения линий располагаются бусины. Эти точки именуются узлами сетки. Так как все ячейки нашей сетки идентичны между собой, то для описания геометрического расположения частиц в слое можно указать параметры одной ячейки. В этом случае ячейка представляет собой ромб с острым углом равным шестидесяти градусам, и длиной стороны, равной удвоенному радиусу бусины.
Начинаем строить второй монослой. Его укладываем на первый монослой, при этом одну бусинку мы укладываем на первый слой так, чтобы она соприкасалась с нашей центральной. А значит она у нас расположится во впадине. Вокруг центральной бусины у нас располагаются шесть впадин, а расстояние между ними чуть больше радиуса бусины. Значит во втором слое бусин с центральной бусиной у нас соприкоснуться уже три бусины, вместо шести (обозначим их как 7-9). Хорошо видно, что три бусины второго слоя можно расположить несколькими способами:
- помещаем их во впадины между Ц, 1, 2; Ц 3,4; Ц,5,6;
- помещаем в углубления Ц, 2, 3; Ц, 4, 5; Ц, 1, 6;
По отношению к центральной бусине все варианты абсолютно одинаковые. Давайте возьмем первый слой размещения бусин для второго монослоя. Так как центры частиц первого и второго слоев не совпадают, то сетка второго слоя смещена относительно первого.
Начинаем заполнять третий слой после второго. Тут тоже есть два варианта расположения. Они абсолютно неидентичных между собой. В первом случае бусина помещается в впадину А и тогда у нас сетка сдвигается на треть. Очерчиваем мысленно окружность вокруг точки А и понимаем, что в этом случае сетка четвертого слоя совпадает с первым слоем.
Другой случай — это расположение бусин третьего слоя во впадинах Б. В таком случае сетка третьего слоя совпадает с сеткой первого, а сетка второго – с стекой четвертого.
То есть у нас существует несколько типов упаковки бусин в виде чередования слоев. Это 1, 2,1,2,1,2 и 1,2,3,1,2,3,1,2,3.
В первом случае – речь идет о так называемой гексагональной упаковке, а во втором о кубической.
Большое количество металлов кристаллизуются по одному из этих типов плотной упаковки.
При этом как бы не старались заполнить пустоты бусинами, все равно часть пространства будет пустым. А теперь посмотрим на бусины через боковые стенки сосуда. Видно, что три бусины одного слоя и одна другого образуют систему за которой, скрывается пустота. Центры этих четырех бусин располагаются в вершинах тетраэдра , а значит пустота именуется тетраэдрической.
Октаэдрический тип –это образование пустоты между тремя бусинами одного слоя и тремя другого.
Роль таких пустот чрезвычайно важно при образовании кристалла частицами с разным размером. В этом случае у нас частицы с большим радиусом располагаются так, чтобы получилась плотная упаковка, а меньшие располагаются в образованных этими частицами пустотами.
Совокупность сеток, советующих всем слоям частиц кристалла, представляет собой пространственную систему, именуемой кристаллической решеткой. Среди характеристик сетки можно выделить параметры ячейки ее размеры, сторон и величину углов. Существует огромное множество форм кристаллических решеток. Изучением кристаллических решеток занимается кристаллография.
А теперь давайте рассмотрим кристалл не с точки зрения его «устройства», а с точки зрения химических сил, обеспечивающих связь в этих кристаллах.

Типы химической связи
По характеру связи между частицами кристаллы подразделяются на четыре вида: молекулярные, атомные, ионные и металлические. Конечно, вы помните, что не может быть стопроцентной одной связи (только ионной или только металлической, важно какой вид преобладает). Давайте рассмотрим каждый тип подробно.
Молекулярная кристаллическая решетка
Молекулярная решетка в своих узлах имеет молекулы. Связь между молекулами обеспечивается за счет Ван-дер-Вальсового взаимодействия. Это достаточно слабые взаимодействие, поэтому внутримолекулярные и межмолекулярные расстояния между атомами абсолютно разные. За счет малой энергии ван-дер-ваальсового взаимодействия по сравнению с ковалентной связью в молекулах, кристаллы с молекулярным типом кристаллической решетки легко переходят в газообразное состояние при достаточно низких температурах. Большинство органических соединений имеют молекулярный тип решетки из неоргаников — это водород, сера, вода, азот, иод.
Атомная кристаллическая решетка
Атомный тип кристаллической решетки. К таким кристаллам относится алмаз, атом углерода в котором окружен четырьмя другими атомами, равноудаленных от него. Все связи между атомами имеют одинаковую длину и равную энергию. Атомный кристалл характеризуется единой системой химических связей. Атомы связаны направленными, локализованными ковалентными связями. Они определяют энергетические характеристики кристалл, группировки атомов. Ковалентные связи в атомных решетках имеют высокую прочность, соответственно разрушить подобный кристалл весьма проблематично, особенно по сравнению с молекулярным. Вещества с атомными решетками имеют высокую прочность, и высокую температуру плавления и кипения.

Ионная кристаллическая решетка
Ионная кристаллическая решетка образуется чередующимися ионами противоположными по знакам. К примеру, кубический кристалл хлорида натрия (поваренная соль) относится к классическому примеру ионного кристалла. В ионной решетке нет возможности вычленить отдельную молекулу хлорида натрия – все ионы кристалла взаимодействуют между собой. То есть любой положительный ион натрия притягивает отрицательно заряженный ион хлора и отталкивает другие ионы натрия. Каждый ион в кристалле образует сферически симметричное электростатическое поле, взаимодействие между ионами происходит за счет кулоновских сил. Число соседей каждого иона определяется соотношением размеров ионов и принципом электронейтральности.
Энергетической характеристикой ионного кристалл является энергия ионной кристаллической решетки.
Энергия ионной кристаллической решетки – это энергия образования одного моля кристаллического вещества из свободных газообразных ионов. Рассчитывается исходя из законов электростатики, либо по циклу Борна-Габера.
Энергия ионной решетки сопоставима с энергией химических связей в атомных кристаллических решетках, что обуславливает достаточно прочные кристаллы и трудное их разрушение.
Металлическая кристаллическая решетка
Металлические кристаллические решетки имеют существенное отличие от молекулярных и атомных решеток. Кристаллы обладают характерным блеском, легко деформируются обладают высокими показателями теплопроводности и электропроводности. В металлическом кристалле атомы связаны друг с другом тем прочнее, чем больше электронов участвует в образовании связей. Это объясняет наличие в ряду металлов легкоплавки и легколетучих ( ртуть), щелочные металлы.
Надеемся мы смогли вам объяснить «на пальцах» очередной материал, необходимый для успешной подготовки к сдаче ЕГЭ по химии за минимальный срок.
Кристаллическая решетка и типы кристаллических решеток
Большинство веществ, в зависимости от условий (темература, давление) могут находится в трех агрегатных состояниях. Все твердые вещества можно разделить на аморфные и кристаллические. Каждое вещество имеет четкую структуру атомов, которые образуют определенную геометрическую структуру, называемую кристаллическая решетка. Но при этом у каждого такого вещества типы кристаллических решеток будут разными.
- Кристаллическое и аморфное вещество
- Ионные кристаллы
- Атомные кристаллы
- Молекулярные кристаллы
- Семь типов кристаллических решеток
- Кубическая (или изометрическая) решетка
- Квадратичная (или тетрагональная) решетка
- Орторомбическая кристаллическая решетка
- Моноклинная решетка
- Триклинная решетка
- Ромбоэдрическая решетка
- Гексагональная кристаллическая решетка
Кристаллическое и аморфное вещество
Кристаллическое вещество: твердое вещество, у которого атомы или молекулы образуют правильную упорядоченную решетку. Большинство твердых веществ существует в кристаллическом состоянии, которое отличается повышенной стабильностью, но это не означает, что они имеют кристаллы в прямом смысле этого слова; например, чистая медь является кристаллической только потому, что ее атомы расположены в регулярном порядке.
Аморфное вещество: твердое вещество, не имеющее кристаллической структуры. Его атомы и молекулы расположены без соблюдения регулярности. Переохлажденные жидкости, такие как стекло, резина и некоторые пластмассы, являются аморфными.
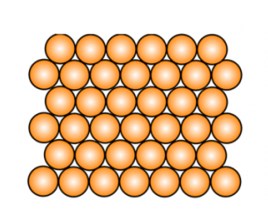 Кристаллическая структура
Кристаллическая структура 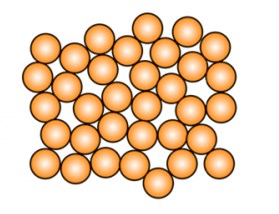 Аморфная структура
Аморфная структура
Сейчас мы будем рассматривать только кристаллические вещества.
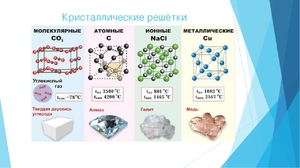
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов. Выделяют 4 типа кристаллических решеток (КР): Молекулярная, ионная, металлическая и атомная.
Типы кристаллических решеток
Галогены: F2, Cl2
Галогеноводороды: HF, HCl …
Простые вещества неметаллы:
О2, Н2, N2, P(белый)
CaC2, SiC (карборунд),
Ионные кристаллы
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь. Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов.
Атомные кристаллы
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы. Они очень прочные и твердые, плохо проводят теплоту и электричество.
Молекулярные кристаллы
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл.
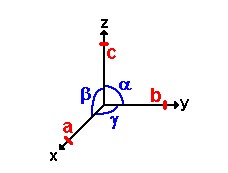
Семь типов кристаллических решеток
Есть семь разных кристаллических систем. Они были обнаружены в 1781 году отцом Рене Джаст Хауи. Он случайно заметил, что некоторые камни имеют идеальную форму. После многих лет исследований он разработал свою теорию о структуре кристаллов. В 1848 году Огюст Браве показывает, что может быть только семь типов элементарной кристаллической сетки.
Системы характеризуют различные геометрические формы, которые может иметь кристаллическая сетка.
Каждая из этих систем определяется своими осями: три размерных параметра (длина осей) и три угловых параметра (углы, образованные двумя осями). Условно мы называем abc длинами осей и α β и γ углами, образованными осями. Они размещены в пространстве следующим образом:
Каждая ячейка, представляющая систему, также имеет определенное количество симметрий. Эти симметрии бывают трех типов:
- центральный (отмечен С): точка является центром симметрии сетки;
- плоскости (отмечено P): плоскость является плоскостью симметрии сетки;
- осевой (О): поворот на определенный угол вокруг оси симметрии возвращает сетку в положение, идентичное исходному.
Эти симметрии имеют четыре порядка:
- двоичные ( обозначено L 2 ): вращение на 180 ° (π рад)
- троичное (обозначено L 3 ): вращение на 120 ° (2π/3 рад)
- четвертичное (отмечено L 4 ): Вращение на 90 ° (π/2 рад.)
- гексагональное (отмечено L 6 ): вращение на 60 ° (π/3 рад.)
Кубическая (или изометрическая) решетка
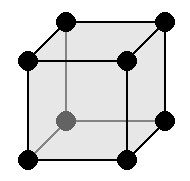 |
a = b = c: три оси имеют одинаковую длину α = β = γ= 90 °: три угла равны и прямые Симметрии: C, 3 L 4 , 4 L 3, 6L 2, 9 P Базовый элемент — это куб. |
Квадратичная (или тетрагональная) решетка
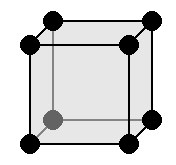 |
a = b ≠ c: две оси имеют одинаковую длину, а третья ось различается. α = β = γ= 90 °: три угла равны и прямые Симметрии: C, L 4 , 4L2, 5 P Основным элементом является правая призма с квадратным основанием. |
Орторомбическая кристаллическая решетка
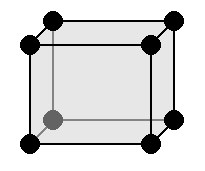 |
a ≠ b ≠ c: три оси имеют разную длину α = β = γ= 90 °: три угла равны и прямые Симметрии: C, 3 L 2, 3 P Основной элемент — прямоугольный параллелепипед. |
Моноклинная решетка
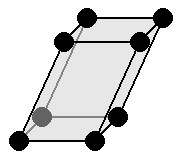 |
a≠b≠c : три оси имеют неравную длину. β = γ= 90 °≠α: два угла равны и прямые. Симметрии: C, L 2 , P Основным элементом является наклонная призма, в основании которой ромб. |
Триклинная решетка
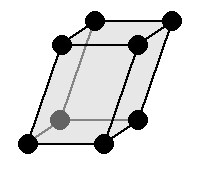 |
a≠b≠c: три оси имеют неравную длину. α≠β ≠ γ≠ 90 °: три угла разные. Симметрии: C, L 2 , P Основной элемент — это параллелепипед с основанием ромб. |
Ромбоэдрическая решетка
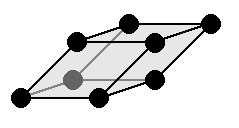 |
a = b = c: три оси имеют одинаковую длину α = β = γ≠ 90 °: три угла равны и прямые Симметрии: C, L 3 , 3 L 2 , P Основным элементом является параллелепипед все плоскости которого — ромбы. |
Гексагональная кристаллическая решетка
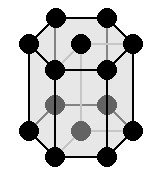 |
a = b ≠ c: две оси имеют одинаковую длину, не равную длине третьей оси α = β = 90° и γ=120 0 : три угла равны и прямые Симметрии: C, L 6 , 6 L 2 , 7 P Базовым элементом является призма с шестиугольным основанием. |
Таким образом, мы с вами рассмотрели подробно понятие кристаллическая решетка и то, какими бывают основные кристаллические решетки.
