Какую кристаллическую решетку имеет медь?
МЕДЬ — фундамент цивилизации
Не меньше 9000 лет назад человек уже изготавливал первые предметы из меди. Так говорят археологи и подтверждают их находки из тех древних времен.
Не будь этого металла, вся наша история была бы другой. Именно металл медь стал первой ступенькой в развитии в металлургии и фундаментом цивилизации. Именно с этого металла началось развитие человечества.
От Турции до Египта
История открытия металла затерялась в веках. Кто первый обнаружил металл, кто догадался «обстучать» самородок, чтоб из него получилось лезвие или другой инструмент — неизвестно. Тем более никто не знает, кто додумался «сварить» самородок и залить жидкий металл в форму.

Следующая загадка — кто первым стал плавить из руды металл. Зато известно, что самые древние находки медных изделий и шлак от плавки археологи нашли в современной Турции. Древность несусветная — им до 10 000 лет.
Почему медь?
Племена, жившие в Европе в древности, называли медь и любые металлы «мида». В старинных русских текстах слово «медь» также встречается. Ученые считают слово родственным древнегерманскому «smid» (кузнец); либо производным от Мидия — страны на территории нынешнего Ирана.
По-латыни медь называют купрум (aes cuprium), от острова Кипр. Там было богатое месторождение металла. Плиний пишет:
«…Известно, сколь долго римский народ пользовался лишь медной монетой. Сама древность свидетельствует о важном значении этого металла».
Долгое время главная расхожая монета Римской империи называлась асс (aes).
Сейчас «медь» и «купрум» мирно делят принадлежность к цветному металлу.
Свойства металла

Медь находится в 11-й группе периодической таблицы Менделеева, в так называемой «троице дорогих металлов» — медь, золото, серебро. Атомный номер 29. Цвет металла желтовато-розовый, близкий к оранжевому.
В классификации элемент находится в группе переходных металлов.
Физические свойства оценили давно, и востребованы они до сих пор. Это отменные тепло- и электропроводность. По этим показателям медь уступает только серебру; наличие примесей (олово, железо, мышьяк) показатели ухудшают.
Чистая медь мягкая, ковкая, хорошо поддается прокатке. Проволоку можно довести до диаметра в тысячные доли миллиметра.
Плотность 8,92 г/см3. Плавится при 1083,4 °С, кипит при 2567 °С.
| Свойства атома | |
|---|---|
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
| Атомная масса (молярная масса) |
63,546(3)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1083,4 °С) |
| Температура кипения | 2567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Кристаллическая структура решетки гранецентрическая, кубическая.
Химические свойства элемента привлекательны для промышленности:
- Металлическая медь довольно стабильна и малоактивна. Шпили старых церквей покрывали медными листами, которые исправно защищали кровлю многие годы.
- Проявляет степени окисления 3, 2, 1, 0.
- Металл не растворяется в разбавленных серной и соляной кислотах, а вот концентрированная азотная кислота с медью охотно реагирует.
- Легко реагирует с серой, галогенами (йод, фтор, хлор).
В природе состоит из изотопов 63Cu и 65Cu.
Соединения меди
Чаще всего в природе встречается медный купорос, сульфат меди. Дачники и огородники хорошо знают этот синий порошок. Его применяют для дезинфекции растений от насекомых.
Ацетат меди — фунгицид, компонент краски для керамики.
Парижская (швейнфуртская) зелень, ацетат-арсенид меди. До сих пор используют в окраске наружных частей морских судов (чтобы они не обрастали моллюсками и прочей морской живностью). Фунгицит, инсектицид.
Оксиды используют в окраске стекла и эмалей.
Нитраты применяют для патинирования медных изделий.
Со временем на них образуется естественная патина — зеленоватая оксидно-карбонатная пленка. Иногда патину наращивают искусственно, для состаривания, придания антикварного вида изделию.
Ищем медь
Запасы металла на земле немалые. В их число входит самородная медь (ее скопления могут достигать 400 тонн — бери готовую).
Нет самородной, к услугам человека содержащие медь минералы:
- медный колчедан (халькопирит);
- борнит (сульфид меди и железа); раньше его называли пестрый медный колчедан;
- халькозин, медный блеск (сульфид меди);
- малахит, карбонат меди; уральский малахит высочайшего качества уже использован, теперь малахит добывают в Африке;
- куприт (красная медная руда);
- азурит, медная лазурь.
Месторождения и добыча
Происхождение медных руд разнообразное. Они бывают оксидные, сульфидные, смешанные. Больше всего на земле сульфидных руд (около 90%), в них богатые руды. Не уступают содержанием металла окисленные минералы.
Крупные месторождения есть в Чили (прогнозируемые запасы больше 5 миллионов тонн).

Богатейшие месторождения самородной меди находятся в США (озеро Верхнее), на острове Ванкуве (Канада), Корокоро (Боливия).
Самородная «космическая» медь найдена в метеоритах и на Луне.
В России добыча металла ведется в Красноярском крае (все тот же «Норникель»).
Как выплавить купрум
Способы получения меди:
- пирометаллургический (с его помощью производят 90% металла);
- гидрометаллургический, оставшиеся 10%.
Гидрометаллургия состоит из единственного этапа — обработки руды (обычно бедной) разбавленной серной кислотой с последующим выделением из раствора металлической меди. При этом все попутные вещества из руды просто пропадают.
Пирометаллургия сложнее, там несколько этапов:
- Обогащение методом флотации и окислительного обжига.
- Плавка на штейн при температуре до 1500 градусов. Здесь уже выделяют черновой металл, а также сопутствующие серебро, золото, никель.
- Огневое рафинирование — очистка полученного металла от примесей до чистоты 99,5%.
- Электролитическое рафинирование, доведение чистоты до 99,95%.
Сплавы, лигатуры…
Медь входит в состав множества сплавов:
- мельхиор;
- латунь;
- бронза;
- латтен (латон);
- нейзильбер (применяют в ювелирном деле);
- абиссинское золото;
- французское золото;
- северное золото.
Свойства металла, входящих в сплав, позволяют металлургам «сочинять» требуемые характеристики.
Медь стоит недешево, потому производители предпочитают медные сплавы (там, где это возможно).
В некоторых областях сплавы (особенно с алюминием) уверенно обогнали чистый металл. «Маме»-меди не сравниться с коррозионной стойкостью, прочностью, ковкостью сплавов.
Голубая кровь
Это выражение слышали все. Не все знают, что кровь голубого цвета есть в действительности, но не у людей. Белок гемоцианин окрашивает в голубой цвет кровь моллюсков, многоножек, паукообразных. Сам гемоцианин — аналог гемоглобина, который делает нашу кровь красной.
Без нашего героя человек не смог бы выжить и как биологический вид. Металл способствует усвоению белков, углеводов, укрепляет иммунитет. Не зря наши прабабки варили варенье в медных тазах, ведь металл обладает антисептическими свойствами.
Ионы металла обладают антигрибковыми и противовирусными свойствами, способны проникать через клеточную мембрану и уничтожают распространителей заразы.
Уже существует ткань, содержащая медные нити. Вечернего платья и костюма из нее не сошьешь, вот в больницах она необходима. Материал разработали в Чили.
Применение металла: от телеграфа до фейерверков
Широкое применение меди началось после изобретения телеграфа. Понадобились огромные объемы металла для телеграфных проводов. С этого времени наш герой не покидает первого места в рейтинге электротехнических металлов.
Применение меди основано на ее свойствах. Электропроводка в старых домах; сейчас дорогой металл заменяют на дешевый алюминий. А вот в приборах медные проводки присутствуют. Компьютеры оснащены медными теплоотводами.
Сантехническое оборудование, холодильная техника, кондиционеры — везде задействован цветной металл с его замечательными свойствами.

Корабли и кораблики гордятся медными трубопроводами (в них течет жидкость и газ).
А во многих странах медные трубы применяют для водо- и газоснабжения зданий.
Без меди не будет твердого припоя (это «клей» для металлов).
Диоскурид писал: «Из детской мочи и кипрской меди приготовляется припой для золота».
Япония считает медные трубы газопроводов сейсмостойкими.
Медь применяют как лигатуру для золотых сплавов; чистое золото слишком мягкий и склонный к истиранию металл.
Оранжевый цветной металл дает синий цвет пиротехническим изделиям.
Чего мы не знали о меди
Одно из преимуществ удивительного металла — изготовленные из него инструменты не дают искр при ударе. Разумно использовать их там, где есть вероятность взрыва.
Шведские ученые придумали способ захоронения радиоактивных отходов. Сейчас на это тратятся огромные средства. А можно просто помещать радиоактивный хлам в медные капсулы с толщиной стенок 5 сантиметров. По расчетам, коррозия их разрушит не раньше, чем через полмиллиона лет.
Многие знают, что Статуя Свободы (та самая, с факелом и в короне) изготовлена из меди. Не целиком, конечно, цветной металл только сверху, внутри стальные конструкции. Ходили слухи, что изготовлена она из уральского металла, но… Официально признано, что тот цветмет из Норвегии.
Вот случай, когда вроде полезное свойство нашего героя стало недостатком. Норвежское грузовое судно затонуло по вине медной руды, которую и везло. Виновата электрохимия. Медь из руды создала гальваническую пару с металлическим корпусом судна, электролитом послужили испарения морской воды. Возникший ток спровоцировал такую коррозию, что она проела обшивку, и в трюмы хлынула вода.
Модникам и модницам
Секрет джинсов «Gold Vision-3000» в медном биокорсете. Медные нити, «встроенные» в модные штаны, помогают предотвращать сосудистые патологии, стимулируют работу органов малого таза. А они влияют на пищеварение, половую функцию, кроветворение, уменьшают вредное воздействие бытовых приборов, влияние электромагнитных полей.
На биржу или в Лагич?
Биржевая цена за тонну меди сегодня доходит до 5200 $ США.
Не хотите покупать металл тоннами, а желаете иметь красивое и полезное украшение для дома — поезжайте в Азербайджан, в село Лагич. Там испокон развивалось ремесло медников. Их посуда — чаши, кувшины, блюда — совершенны в своей красоте.
Покупайте их смело. Не зря ведь в Лувре, Венском и Бернском музеях хранятся образцы творчества азербайджанских мастеров медных дел.
1.Металлы. Строение и свойства металлов. Металлическая связь. Типы кристаллических решёток металлов. Полиморфизм и анизотропия.
Объемно-центрированная кубическая (ОЦК) (2 атома на ячейку), б)
Гранецентрированная кубическая (ГЦК) (4 атома на ячейку), в)
Гексагональная плотноупакованная (ГП) (6 атомов на ячейку), г)
Рис. 2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 2, б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряется в нанометрах (1 нм = 10 -9 м =10 A). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра – сторону шестигранника а и высоту призмы с. Когда отношение с/а =1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 1, г). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357-0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.

Рис. 3. Координационное число в различных кристаллических решетках для атома А: а) – объемноцентрированная кубическая (К 8); б) – гранецентрированная кубическая (К 12); в) – гексагональная плотноупакованная (Г 12)
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
В ОЦК решетке (рис. 3, а
) атом
А
(в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К 8).
В ГЦК решетке (рис. 3, б)
атом
А
(на грани куба) находится на наиболее близком равном расстоянии от четырех атомов
1
,
2, 3, 4,
расположенных в вершинах куба, от четырех атомов
5, 6, 7, 8,
расположенных на гранях куба, и, кроме того, от четырех атомов
9, 10, 11, 12,
принадлежащих расположенной рядом кристаллической ячейке. Атомы
9, 10, 11, 12
симметричны атомам
5
,
6, 7, 8.
Таким образом, ГЦК решетки координационное число равно 12 (К 12).
В ГПУ решетке при с/а =
1,633 (рис. 3,
в
) атом
А
в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов
1
,
2, 3, 4, 5, 6,
размещенных в вершинах шестигранника, и от трех атомов
7, 8, 9,
расположенных в средней плоскости призмы. Кроме того, атом
А
оказывается на таком же расстоянии еще от трех атомов
10, 11, 12,
принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы
10, 11, 12
симметричны атомам
7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г 12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки (“поры”) 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а “поры” 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
У некоторых металлов кристаллическая решетка может изменяться при изменении температуры. Это явление называется полиморфизмом
или
аллотропией
. Полиморфизм может вызывать изменение свойств.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
1. Кристаллическая структура меди
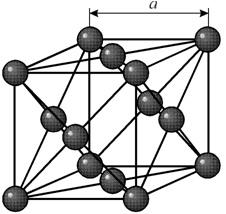
Рис. 1. Крист. структура меди.
1. Из равенства осевых единицa=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число атомов меди в элементарной ячейке 1/8*8+1/2*6=4. 1/8 – доля каждого атома меди, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1/2 – доля каждого атома находящегося в грани элементарной ячейки меди.
3. Атомы меди образуют сложную кубическую гранецентрированную ячейку Бравэ.
4. Поскольку ячейки атомов меди гранецентрированные, в базисе указываются координаты 4-х атомов. [[000;1/2 1/2 0; 1/2 0 1/2;0 1/2 1/2]]. Записывая базис, мы указываем координаты тех атомов, трансляцией которых можно получить всю пространственную решетку.
5. Основные трансляции для атомов меди – 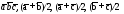 . Перемещая любой из атомов меди (например, расположенный в начале координат) на величины
. Перемещая любой из атомов меди (например, расположенный в начале координат) на величины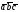 , мы получим все другие атомы меди в пространственной решетке, расположенные в вершинах ячеек.
, мы получим все другие атомы меди в пространственной решетке, расположенные в вершинах ячеек.
6. В структуре меди любой атом, расположенный в вершине ячейки имеет двенадцать ближайших соседей, которыми является атомы, находящиеся в центрах граней. Поэтому КЧ=12.
2. Кристаллическая структура вольфрама.
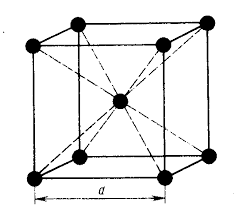
Рис. 2. Крист. структура вольфрама
1. Из равенства осевых единиц a=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число атомов вольфрама в элементарной ячейке, ZW= 1/8 х 8 +1= 2, где 1/8 — доля каждого атома вольфрама, находящегося в вершине, в элементарной ячейке данной структуры; 8 — число такихатомов. 1 атом находится в центре ячейки.
3. Атомы вольфрама образуют сложную кубическую объемноцентрированную ячейку Бравэ.
4. Базисы для атомов вольфрама -[[1/2 1/2 1/2]], [[000]]. Записывая базис, мы указываем координаты того атома, трансляцией которого можно получить всю пространственную решетку.
5. Основные трансляции для атомов вольфрама – 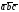 . Перемещая атом, расположенный в начале координат на величины
. Перемещая атом, расположенный в начале координат на величины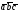 .
.
6. В структуре вольфрама каждый атом окружен восемью атомами, расположенными в вершинах ячейки. КЧ=8.
3. Кристаллическая структура , α-Ti
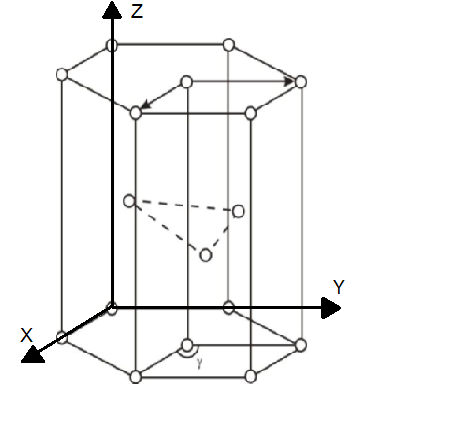
Рис. 3. Крист. структура α-Ti.
1. Из равенства осевых единиц a=b≠c и осевых углов α=β =90°,γ=120 следует, что сингония является гексагональной
2. Определим число атомов α-Ti в элементарной ячейке 1/8*8+1=2. 1/8 – доля каждого атома α-Ti, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1 –атома находящегося внутри элементарной ячейки.
3. Из рис. 4 очевидно, что атомы α-Ti образуют гексагональную компактную плотноупакованная решетку Браве.
4. Базисы для атомов α-Ti -[[2/3 1/3 1/2]], [[000]]. Записывая базис, мы указываем координаты того атома, трансляцией которого можно получить всю пространственную решетку.
5. – 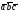 ,222222 . Они присущи примитивной ячейке Браве. Перемещая любой из атомов α-Ti (например, расположенный в начале координат) на величины
,222222 . Они присущи примитивной ячейке Браве. Перемещая любой из атомов α-Ti (например, расположенный в начале координат) на величины , мы получим все другие атомы в пространственной решетке, расположенные в вершинах ячеек. Также транслируя 2222222 мы получим атомы внутри решетки.
, мы получим все другие атомы в пространственной решетке, расположенные в вершинах ячеек. Также транслируя 2222222 мы получим атомы внутри решетки.
6. В структуре α-Ti каждый атом имеет 12 ближайших соседей атомов поэтому КЧ = 12.
4. Кристаллическая структура NaCl
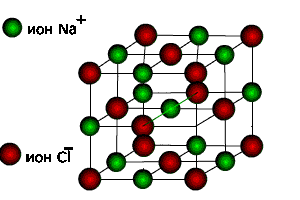
Рис. 4 Крист. структура NaCl.
1. Из равенства осевых единиц a=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число ионов натрия ZNa и хлораZClв элементарной ячейке,ZNa= 1/8 х 4 = 1/2, где 1/8 — доля каждого иона натрия, находящегося в вершине, в элементарной ячейке данной структуры; 4 — число таких ионов.ZCl= 1/8 х 4 = 1/2, где 1/8 — доля каждого иона хлора, находящегося в вершине, в элементарной ячейке данной структуры; 4 — число таких ионов. Число ионов натрия равно числу ионов хлора.
3. Из рис. 4, очевидно, что ионы натрия образуют кубическую гранецентрированную ячейку Браве. Чтобы определить, какую ячейку образует ионы хлора, нужно рассмотреть и соседние ячейки. Выделив в них ионы хлора, нетрудно видеть, что они также образуют гранецентрированную ячейку Браве Р.
4. Запишем базис для ионов натрия и ионов хлора. Поскольку ячейки ионов натрия и хлора примитивные, в базисе указываются координаты двух ионов. Для иона хлора — [[1/2 1/2 1/2]], [[000]]. Для иона натрия — [[1/2 1/2 1/2]], [[000]].
5. Основные трансляции для ионов натрия –  . Для ионов хлора трансляция те же.
. Для ионов хлора трансляция те же.
6. В структуре хлористого натрия каждый ион хлора окружен шестью ионами натрия. Число ближайших ионов хлора к каждому иону натрия также равно шести.. Поэтому КЧNaпо Cl = 6 и КЧСl поNa= 6.
Типы кристаллических решёток
Урок 9. Химия 11 класс ФГОС

В данный момент вы не можете посмотреть или раздать видеоурок ученикам в личном кабинете
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно его приобрести.
Получите невероятные возможности



Конспект урока «Типы кристаллических решёток»
Для определения типа кристаллической решётки поступают следующим образом. Если связь в соединении ионная, то кристаллическая решётка всегда ионного типа: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.
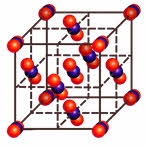
Если связь металлическая, то и кристаллическая решётка всегда металлическая: латунь, железо, медь, натрий.

Если связь ковалентная, то решётка может быть, как атомной, так и молекулярной. Веществами с атомной кристаллической решёткой являются: карборунд, оксид кремния четыре, бор, кремний, алмаз, графит, чёрный и красный фосфор.

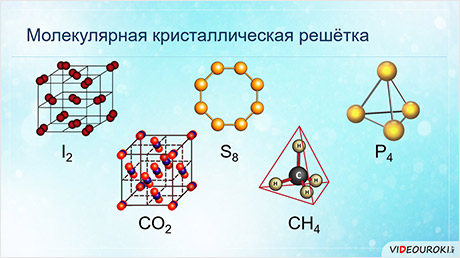
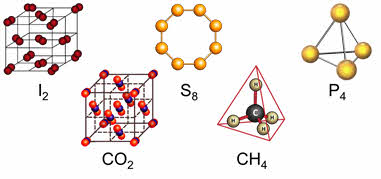
У веществ с молекулярной кристаллической решёткой в узлах кристаллической решётки расположены молекулы, прочность данной связи слабая.
Для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, то есть они легкоплавки и летучи, значительная сжимаемость, иногда запах, а также явление сублимации, или возгонки, как для йода и твёрдого углекислого газа.
Для веществ с молекулярной кристаллической решёткой характерна небольшая твёрдость, большинство этих веществ хорошо растворимы в воде. Молекулярную кристаллическую решётку имеют газы и жидкости в твёрдом агрегатном состоянии. Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.
У веществ с атомной кристаллической решёткой в узлах расположены атомы. Связь между атомами в кристаллические решётки – ковалентная, очень прочная. Для этих веществ характерны высокие температуры кипения и плавления, то есть они тугоплавки и нелетучий, очень твёрдые, практически не растворимы в воде и не имеют запаха.
Примером веществ с таким типом кристаллических решёток являются алмаз и графит.
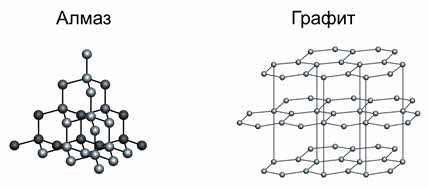
Как известно, твёрдость алмаза оценивается по шкале Мооса самым высоким значением – 10. Благодаря высокой твёрдости алмаз используют для изготовления буров, свёрл, шлифовальных инструментов, стеклорезов. Алмаз является камнем ювелиров, они используют отшлифованные алмазы – бриллианты.
Графит также является веществом с атомной кристаллической решёткой, но несмотря на это, он мягкий, так как имеет слоистую структуру. В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники. Связи между слоями непрочные, за счёт этого графит мягкий. Графит, как и алмаз, тугоплавкий. Из него изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия. Такие, как наждак, корунд, рубин, сапфир.

Наиболее распространённое соединение кремния – это оксид кремния четыре, который также имеет атомную кристаллическую решётку. Почти чистым оксидом кремния четыре является минерал кварц.

У веществ с ионным типом связи в узлах кристаллической решётки расположены ионы, связь между частицами – ионная, она прочная.
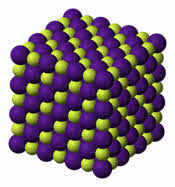
Для веществ с ионным типом связи характерны следующие свойства: высокие температуры плавления и кипения, они тугоплавки и нелетучи, они твёрдые, хрупкие, многие растворимы в воде. Их хрупкость объясняется тем, что если попробовать деформировать такую кристаллическую решётку, то один из её слоёв будет двигаться относительно другого слоя до тех пор, пока одинаково заряженные ионы не будут друг против друга. Эти ионы начнут отталкиваться друг от друга, и кристаллическая решётка разрушиться.
Вещества с ионным типом связи плохо проводят электрический ток и тепло. Но их растворы и расплавы проводят электрический ток. Вещества с ионным типом связи не имеют запаха.
Ионное соединение представляет собой гигантскую ассоциацию ионов, расположенных в пространстве благодаря равновесию сил притяжения и отталкивания.
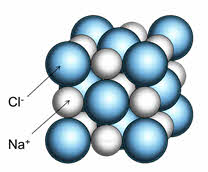
Например, кристалл хлорида натрия состоит из катионов натрия и анионов хлора. Каждый катион натрия окружён шестью анионами хлора, а каждый анион хлора – шестью катионами натрия. Наименьшей структурной единицей кристалла является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
У веществ с металлическим типом связи в узлах кристаллической решётки расположены атом-ионы, связь между ними металлическая. Связь может быть различной по прочности.
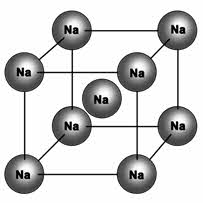
Металлическая кристаллическая решётка определяет свойства металлов: ковкость, пластичность, электро-и теплопроводность, металлический блеск, способность образовывать сплавы.
Пластичность выражается в способности металлов деформироваться под действием механической нагрузки. Это свойство лежит в основе ковки, прокатки металлов, их способности вытягиваться в проволоку. Пластичность объясняется тем, что под воздействием силы слои перемещаются относительно друг друга без разрыва связи между ними.
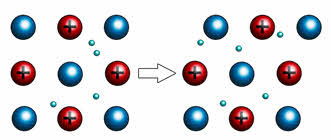
Например, если двумя плоскими стеклянными пластинками поместить несколько капель воды, то пластинки будут свободно скользить относительно друг друга, но вот разъединить их будет достаточно сложно. Таким образом, в данном опыте вода играла роль свободных электронов, которые находятся в металлической кристаллической решётке.
Наиболее пластичными металлами являются золото, серебро и медь. Именно из золота можно сделать самую тонкую фольгу толщиной три тысячных миллиметра. Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Высокая электропроводность металлов обусловлена наличием свободных электронов, которые под действием электрического тока приобретают направленное движение.
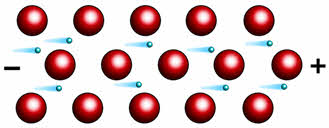
Лучшими проводниками электрического ока являются серебро и медь, немного худшим – алюминий. Однако в большинстве случаев в качестве электропроводов используют алюминий, а не медь.
Теплопроводность металлов также объясняется движением свободных электронов, которые сталкиваются с атом-ионами в узлах кристаллической решётки и обмениваются с ними энергией. Благодаря этому свойству металлическая посуда равномерно нагревается.
Вещества с металлическим типом кристаллической решётки имеют металлический блеск из-за отражения световых лучей.
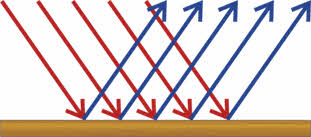
Высокой светоотражающей способностью обладают ртуть, серебро, палладий и алюминий. Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.

Большинство металлов имеет серебристо-белый цвет. Только золото окрашено в жёлтый цвет, а медь в красный.
Металлическая кристаллическая решётка характерна не только для металлов, но и для сплавов. Это отличает металлические сплавы от других сплавов: стекла, фарфора, керамики, базальтов, гранитов, гнейсов.
Какую кристаллическую решетку имеет медь?
Взаимосвязь типа химической связи с видом кристаллической решетки
Вещества и кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток:

Ионная решетка

Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.
Свойства ионных кристаллов :
· твердые, но хрупкие;
· отличаются высокими температурами плавления;
· нелетучи, не имеют запаха;
· расплавы ионных кристаллов обладают электропроводностью;
· многие растворимы в воде; при растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Металлическая решетка

Характерна для веществ с металлической связью. Реализуется в простых веществах — металлах и их сплавах. В узлах решетки — атомы и катионы металла, при этом электроны металла обобществляются и образуют так называемый электронный газ, который движется между узлами решетки, обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и обусловлены свойства веществ с металлической решеткой:
· тепло- и электропроводность;
· обладают металлическим блеском;
· высокие температуры плавления.
Атомная решетка

В узлах решетки — атомы, связанные ковалентными связями. Химическая связь — ковалентная полярная или неполярная. Атомная кристаллическая решетка характерна для углерода (алмаз, графит), бора, кремния, германия, оксида кремния SiO2(кремнезем, кварц, речной песок), карбида кремния SiC (карборунд), нитрида бора BN.
Свойства веществ с атомной решеткой :
· высокие температуры плавления;
Молекулярная решетка

В узлах — молекулы веществ, которые удерживаются в решетке с помощью слабых межмолекулярных сил.
Молекулярное строение имеют:
o все органические вещества (кроме солей);
o вещества — газы и жидкости;
o легкоплавкие и летучие твердые вещества, в молекулах которых ковалентные связи (полярные и неполярные).
Подобные вещества часто имеют запах.
Кристаллические решетки, вид связи и свойства веществ
Т ип решетки
Виды частиц в узлах решетки
Вид связи между частицами
Примеры веществ
Физические свойства веществ
Ионная связь — прочная
Соли, галогениды (IA,IIA), оксиды и гидроксиды щелочных и щел.-зем. металлов
Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток
1. Ковалентная неполярная — очень прочная
2. Ковалентная полярная связь — очень прочная
Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si)
Сложные вещества: оксид алюминия (Al2O3), оксид кремния (IV) SiO2
Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде
Между молекулами — слабые силы межмолекулярного притяжения, внутри молекул — прочная ковалентная связь
При обычных условиях — газы, жидкости или летучие твердые вещества:
Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость
Металлическая связь — разной прочности
Металлы и сплавы
Ковкие, обладают блеском, пластичностью, тепло- и электропроводны
