От чего зависит степень окисления железа?
Урок 28 Бесплатно Железо. Часть первая


Нахождение в природе. Физические свойства железа.
Железо – элемент восьмой группы периодической системы элементов.
Первооткрыватель железа неизвестен – все знают, что оно использовалось с древнейших времён для изготовления орудий труда.
Самые древние изделия из железа относят к IV веку до н. э.

Первые предметы из железа были украшениями, легко догадаться почему. Одно из названий железа на древнегреческом языке – «сидер» переводится как «звездный». Древние люди не умели получать железо из руд и довольствовались лишь метеоритным железом («даром богов»).
Железо – второй по распространённости металл после алюминия, хотя многие ученые предполагают, что земное ядро, составляющее 32 % массы всей планеты, состоит целиком из железа. В пользу этого говорит наличие у Земли магнитного поля, которое возникает из-за вращения железного ядра.

Да и вообще, по своему составу атом железа – уникален.
Все атомы с большим зарядом ядра, то есть элементы, расположенные в периодической системе после железа, менее устойчивы.
Поэтому ученые считают, что железо – наиболее тяжелый элемент, способный образовываться в звездах при термоядерном синтезе.
Именно поэтому ядро Земли и, скорее всего, большинства других планет состоит именно из железа. Как наиболее тяжелый из «звездных» элементов он собирается в центре планеты под действием её гравитационного поля, образуя ядро.
Но в литосфере железо встречается в основном только в виде соединений (не считая метеоритного).
Наиболее важными природными соединениями железа являются:
красный железняк (гематит) Fe2O3
магнитный железняк (магнетит) Fe3O4
серный колчедан (пирит) FeS2
В природных водах и водах некоторых минеральных источников содержатся гидрокарбонат железа Fe(HCO3)2 и некоторые другие его соли.
Соединения железа входят в состав живых организмов.

Железо можно получить восстановлением его из железных руд углеродом (коксом), угарным газом, водородом, алюминием, то есть пирометаллургическим способом.
В промышленности используют доменный процесс, в основе которого лежит реакция с углеродом.

Чистое железо – пластичный металл серебристо-белого цвета.

Он отлично прокатывается, из него можно изготовить листы тоньше папиросной бумаги.
Плотность железа 7,87 г/см 3 , температура плавления 1539 °С.
В отличие от многих других металлов, железо обладает магнитными свойствами.

Магнитные свойства железа связаны со строением атома, а именно распределением электронов по оболочкам.
В периодической системе железо находится в «триаде» элементов:
железо
кобальт
никель
Все три элемента обладают близкими физическими свойствами и строением атома.
Все они являются ферромагнитными, то есть длительное время способны сохранять намагниченность.
Пройти тест и получить оценку можно после входа или регистрации
Химические свойства железа
Химические свойства любого элемента зависят, в первую очередь, от строения ядра, а точнее, от распределения электронов по электронным уровням.
Железо находится в побочной подгруппе VIII группы Периодической системы химических элементов.

Для таких атомов валентными являются и электроны внешнего слоя, и часть электронов предвнешнего уровня.
На предвнешнем уровне атома железа 14 электронов.
Схема строения атома железа такова:

В химических реакциях атомы железа кроме двух электронов внешнего слоя могут отдавать один электрон с предвнешнего слоя и переходить в степень окисления +3.
Кроме того, степень окисления +3 для железа наиболее устойчива.
При обычных условиях железо малоактивно (не взаимодействует даже с активными окислителями), но при нагревании, особенно в мелко раздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
Очень мелкий порошок железа называют «пирофорное железо», оно способно самовоспламеняться на воздухе.

При взаимодействии с кислородом железо образует окалину – двойной (смешанный) оксид железа (II, III) Fe3O4 (FeO x Fe2O3)
Активные неметаллы (фтор, хлор, бром) окисляют железо до устойчивой степени окисления +3, а менее активные – сера, йод – до степени окисления +2:

Железо находится в середине ряда активности металлов, поэтому оно относится к металлам средней активности.
С водой активно реагирует только раскалённое железо.
Железо реагирует с большинством кислот, в том числе с соляной, с разбавленными серной и азотной, вытесняя из них водород и окисляясь до степени окисления +2.

Но концентрированные азотная и серная кислоты при обычной температуре пассивируют железо: образуют на его поверхности плотную пленку, которая препятствует дальнейшей химической реакции.
Поэтому концентрированные азотную и серную кислоты спокойно перевозят в стальных цистернах.

Железо вытесняет (восстанавливает) металлы, которые в ряду активности стоят правее него, из растворов их солей. Например, медь:

Эту реакцию вы можете провести сами.
Растворите в воде немного медного купороса (можно купить в хозяйственном магазине или в магазине, где продаётся всё для сада и огорода) и опустите в этот раствор железный гвоздь.
Медь будет покрывать гвоздь прямо на глазах – реакция идет довольно быстро.

Пройти тест и получить оценку можно после входа или регистрации
§ 17. Железо
Строение и свойства атомов. Железо Fe — элемент побочной подгруппы VIII группы (VIIIB группы) 4-го периода Периодической системы Д. И. Менделеева.
Строение электронной оболочки атомов железа несколько отличается от строения электронных оболочек атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень.
На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах железа таково:

Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но часто и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.
Железо — простое вещество. Это серебристо-белый блестящий металл с температурой плавления 1539 °С. Очень пластичный, поэтому легко обрабатывается, куётся, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твёрдость методами термического и механического воздействия, например с помощью закалки и прокатки.
Различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, оно содержит 0,02—0,04% углерода, а кислорода, серы, азота и фосфора — ещё меньше. Химически чистое железо содержит менее 0,01% примесей.
Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии. Очевидно, знаменитая Делийская колонна сделана из чистого железа (рис. 68).

Рис. 68.
Железная колонна в Дели — один из самых загадочных памятников индийской культуры. Она обладает уникальным свойством: железо, отлитое 15 веков назад, не ржавеет
Первые образцы железа, попавшего в руки человека, по-видимому, были метеоритного происхождения. О знакомстве человека в древности с железом космического происхождения говорит факт наличия у жителей Гренландии, не имевших никакого понятия о железной руде, изделий из железа.
Алхимики обозначали железо в виде копья и щита — характерных атрибутов бога войны Марса.
В настоящее время железо — это основа современной техники и сельскохозяйственного машиностроения, транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы и кончая космическими аппаратами, не может быть изготовлено без применения железа.
Переходя к описанию химических свойств железа, повторим, что оно может проявлять степени окисления +2 и +3, соответственно железо даёт два ряда соединений. Число электронов, которое атом железа отдаёт при химических взаимодействиях, зависит от окислительной способности реагирующих с ним веществ. Например, с галогенами (кроме иода) железо образует галогениды, в которых оно имеет степень окисления +3:

а с серой — сульфид железа (II):

Раскалённое железо сгорает в кислороде с образованием железной окалины:

При высокой температуре (700—900 °С) железо взаимодействует с парами воды:

В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснять металлы, стоящие правее него, из водных растворов их солей, например:

В разбавленных соляной и серной кислотах железо растворяется, окисляясь ионами водорода, при этом образуются соли железа (II) и водород:

Лабораторный опыт № 17
Взаимодействие железа с соляной кислотой
| В пробирку налейте 2—3 мл соляной кислоты и поместите в неё канцелярскую скрепку или 2—3 скобки для степлера. Что наблюдаете? Докажите, что в результате реакции образуются хлорид железа (II) и водород. Запишите уравнение реакции и рассмотрите окислительно-восстановительные процессы. |
Растворяется железо и в разбавленной азотной кислоте, при этом образуются нитрат железа (III), вода и продукт восстановления азотной кислоты — азот N3, оксид азота (II) NO или аммиак NH3 (нитрат аммония NH4NO3) в зависимости от концентрации кислоты.
Концентрированные серная и азотная кислоты пассивируют железо, образуя на поверхности металла плотную, прочную оксидную плёнку.
Соединения железа. По распространённости в земной коре железо занимает четвёртое место среди всех элементов (после кислорода, кремния и алюминия).
В природе железо образует ряд минералов. Это магнитный железняк (магнетит) Fe3O4, красный железняк (гематит) Fe2O3, бурый железняк (лимонит) 2Fe2O3 • ЗН2O. Все они используются в чёрной металлургии для производства чугуна и стали.
Ещё одно природное соединение железа — железный, или серный, колчедан (пирит) FeS2 — не служит железной рудой для получения металла, но применяется для производства серной кислоты.
Как уже было сказано выше, для железа характерны два ряда соединений: соединения железа (II) и железа (III).
Оксид железа (II) FeO и соответствующий ему гидроксид железа (II) Fe(OH)2 получают косвенно, в частности по следующей цепочке превращений:

Оксид и гидроксид железа (II) имеют ярко выраженные основные свойства.
Катионы железа (II) Fe 2+ легко окисляются кислородом воздуха или другими окислителями, например пероксидом водорода, до катионов железа (III) Fe 3+ . Поэтому белый осадок гидроксида железа (II) Fe(OH)2 на воздухе сначала приобретает зелёную окраску, а затем становится бурым, постепенно превращаясь в гидроксид железа (III) Fe(OH)3:

Оксид железа (III) Fe2O3 и соответствующий ему гидроксид железа (III) Fe(OH)3 также получают косвенно, например по цепочке:

Лабораторный опыт № 18
Получение гидроксидов железа (II) и (III) и изучение их свойств
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Кристаллогидрат сульфата железа (II) FeSO4 • 7Н2O, известный под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины и в других целях.
Хлорид железа (III) FeCl3 используют при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа (III) Fe2(SO4)3 • 9Н2O применяют при очистке воды, в качестве растворителя в гидрометаллургии и в других целях.
Для распознавания соединений железа (II) и (III) проводят качественные реакции на ионы Fe 2+ и Fe 3+ . Качественной реакцией на ионы железа (II) Fe 2+ служит реакция солей железа (II) с соединением, формула которого K3[Fe(CN)6], называемым красной кровяной солью. С соединениями такого типа вам ещё предстоит познакомиться в старшей школе. Это особая группа солей, которые, как вы знаете, называют комплексными. Пока же вам нужно усвоить, как диссоциируют такие соли:

Реактивом на ионы железа (III) Fe 3+ является другое комплексное соединение — жёлтая кровяная соль — K4[Fe(CN)6], которая в растворе диссоциирует аналогично:

Если к растворам, содержащим ионы Fe 2+ или Fe 3+ , прилить соответственно растворы красной кровяной соли (реактив на Fe 2+ ) и жёлтой кровяной соли (реактив на Fe 3+ ), то в обоих случаях выпадет одинаковый синий осадок (рис. 69):


Рис. 69.
Качественная реакция на ионы Fe 2+ и Fe 3+
Для обнаружения ионов Fe 3+ также используют взаимодействие солей железа (III) с роданидом калия KSCN или роданидом аммония NH4SCN. При этом образуется ярко окрашенный ион FeSCN 2+ , а раствор приобретает интенсивно-красный цвет (рис. 70):


Рис. 70.
Качественная реакция на ион Fe 3+
Роль химического элемента железа в жизнедеятельности живых организмов очень велика. Оно входит в состав гемоглобина крови, который осуществляет перенос кислорода от органов дыхания к другим органам и тканям.
Соединения железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Для человека и животных источником железа служит пища. В зелёных овощах, таких как шпинат, салат, капуста, много железа. Розовая черешня содержит наполовину меньше железа, чем чёрная. Светло-зелёный капустный лист в шесть раз беднее железом, чем зелёный. В говядине железа больше, чем в телятине.
Новые слова и понятия
- Строение атома железа. Степени окисления железа: +2, +3.
- Физические и химические свойства железа. Образование хлоридов железа (II) и (III), взаимодействие с серой, кислородом, водой, кислотами, солями.
- Железо в природе, минералы железа (магнитный, бурый и красный железняк).
- Соединения катионов железа Fe 2+ и Fe 3+ .
- Качественные реакции на Fe 2+ и Fe 3+ и реактивы: жёлтая и красная кровяная соли, роданид калия.
Задания для самостоятельной работы
- Напишите уравнения реакций, иллюстрирующих генетические ряды соединений Fe 2+ и Fe 3+ . Первые реакции каждого ряда охарактеризуйте с позиций окисления-восстановления, а реакции с участием электролитов запишите также в ионном виде.
- Напишите по два молекулярных уравнения, соответствующих следующим сокращённым ионным уравнениям:

Как называют эти реакции? Напишите названия реактивов.

Рассмотрите два превращения (по выбору) с позиций окисления-восстановления. Реакции с участием электролитов напишите в молекулярной и ионных формах.
От чего зависит степень окисления железа?
Учебно-методическое пособие для подготовки к ЕГЭ
Химия железа
Бражникова Алла Михайловна,
Невского района Санкт-Петербурга
Содержание:
Настоящее пособие рассматривает вопросы по теме «Химия железа». Помимо традиционных теоретических вопросов рассматриваются вопросы, выходящие за рамки базового уровня. Содержатся вопросы для самоконтроля, которые дают возможность учащимся проверить уровень усвоения ими соответствующего учебного материала при подготовке к ЕГЭ.
ГЛАВА 1. ЖЕЛЕЗО – ПРОСТОЕ ВЕЩЕСТВО.
Строение атома железа.
Железо – d-элемент, находится в побочной подгруппе VIIIгруппы периодической системы. Самый распространенный в природе металлпосле алюминия. Входит в состав многих минералов: бурый железняк (гематит) Fe2O3, магнитный железняк (магнетит) Fe3O4, пирит FeS2.
Электронное строение:1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 .
Валентность: II, III, (IV).
Степени окисления: 0, +2, +3, +6 (только в ферратах K2FeO4).
Железо – блестящий, серебристо-белый металл, т. пл. – 1539 0 С.
Получение.
Чистое железо можно получить восстановлением оксидов водородом при нагревании, а также электролизом растворов его солей. Доменный процесс – получение железа в виде сплавов с углеродом (чугун и сталь):
3) FeO + CO → Fe + CO2
Химические свойства.
I. Взаимодействие с простыми веществами – неметаллами
1) С хлором и серой (при нагревании). Более сильным окислителем хлором железо окисляется до Fe 3+ , более слабым – серой – до Fe 2+ :
2) С углем, кремнием и фосфором (при высокой температуре).
3) В сухом воздухе окисляется кислородом, образуя окалину – смесь оксидов железа (II) и (III):
II. Взаимодействие со сложными веществами.
1) Во влажном воздухе протекает коррозия (ржавление) железа:
При высокой температуре (700 – 900 0 С) в отсутствие кислорода железо реагирует с парами воды, вытесняя из неё водород:
2) Вытесняет водород из разбавленной соляной и серной кислот:
Высококонцентрированные серная и азотная кислоты при обычной температуре с железом не реагируют вследствие его пассивации.
Разбавленной азотной кислотой железо окисляется до Fe 3+ , продукты восстановления HNO3 зависят от её концентрации и температуры:
3) Реакция с растворами солей металлов, стоящих правее железа в электрохимическом ряду напряжений металлов:
ГЛАВА2. СОЕДИНЕНИЯ ЖЕЛЕЗА (II).
Оксид железа(II).
Оксид FeO– черный порошок, нерастворим в воде.
Получение.
Восстановление из оксида железа (III) при 500 0 С действием оксида углерода (II):
Химические свойства.
Основный оксид, ему соответствует гидрокосид Fe(OH)2 : растворяется в кислотах, образуя соли железа (II):
Гидроксид железа (II).
Гидроксид железа Fe(OH)2 – нерастворимое в воде основание.
Действие щелочей на соли железа () без доступа воздуха:
Химические свойства.
Гидроксид Fe(OH)2 проявляет основные свойства, хорошо растворяется в минеральных кислотах, образуя соли.
При нагревании разлагается:
Окислительно-восстановительные свойства.
Соединения железа (II) проявляют достаточно сильные восстановительные свойства, устойчивы только в инертной атмосфере; на воздухе (медленно) или в водном растворе при действии окислителей (быстро) переходят в соединения железа (III):
Соединения железа (II) могут выступать и в роли окислителей:
FeO+ CO→ (температура) Fe+ CO
ГЛАВА 3. СОЕДИНЕНИЯ ЖЕЛЕЗА (III).
Оксид железа(III)
Оксид Fe2O3 – самое устойчивое природное кислородсодержащее соединение железа. Это амфотерный оксид, нерастворимый в воде. Образуется при обжиге пирита FeS2(см. 20.4 «Получение SO2».
Химические свойства.
1)Растворяясь в кислотах, образует соли железа (III):
2) При сплавлении с карбонатом калия образует феррит калия:
3) При действии восстановителей выступает как окислитель:
Гидроксид железа (III)
Гидроксид железа Fe(OH)3 – красно-бурое вещество, нерастворимое в воде.
Получение.
Химические свойства.
Гидроксид Fe(OH)3 – более слабое основание, чем гидроксид железа (II), обладает слабо выраженной амфотерностью.
1) Растворяется в слабых кислотах:
2) При кипячении в 50% растворе NaOHобразует
Соли железа (III).
Подвергаются сильному гидролизу в водном растворе:
Fe 3+ + H2O ↔ Fe(OH) 2+ + H +
При действии сильных восстановителей в водном растворе проявляют окислительные свойства, переходя в соли железа (II):
ГЛАВА4. КАЧЕСТВЕННЫЕ РЕАКЦИИ.
Качественные реакции на ионы Fe 2+ и Fe 3+ .
- Реактивом на ион Fe 2+ является гексацианоферрат (III) калия (красная кровавая соль), который дает с ним интенсивно синий осадок смешанной соли — гексацианоферрат (III) калия-железа (II) или турнбулева синь:
- Реактивом на ион Fe 3+ является тиоцианат-ион (роданид-ион) CNS — , при взаимодействии которого с солями железа (III) образуется вещество кроваво-красного цвета – роданид железа (III) :
3)Ионы Fe 3+ можно обнаружить также с помощью гексацианоферрата (II) калия (желтая кровяная соль). При этом образуется нерастворимое в воде вещество интенсивного синего цвета — гексацианоферрат (II) калия-железа (III) или берлинская лазурь:
ГЛАВА 5. МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЖЕЛЕЗА.
Роль железа в организме.
Железо участвует в образовании гемоглобина в крови, в синтезе гормонов щитовидной железы, в защите организма от бактерий. Оно необходимо для образования иммунных защитных клеток, требуется для «работы» витаминов группы В.
Железо входит в состав более чем 70 различных ферментов, в том числе дыхательных, обеспечивающих процессы дыхания в клетках и тканях, и участвующих в обезвреживании чужеродных веществ, поступающих в организм человека.
Кроветворение. Гемоглобин.
Газообмен в легких и тканях.
Железодефицитная анемия.
Недостаток железа в организме приводит к таким заболеваниям, как анемия, малокровие.
Железодефицитная анемия (ЖДА) — гематологический синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа и проявляющийся анемией и сидеропенией. Основными причинами ЖДА являются кровопотери и недостаток богатой гемом пищи и питья.
Больного может беспокоить усталость, одышка и сердцебиение, особенно после физической нагрузки, часто – головокружение и головные боли, шум вушах, возможен даже обморок. Человек становится раздражительным,нарушается сон, снижается концентрация внимания. Поскольку кровоток в коже снижен, может развиватьсяповышенная чувствительность к холоду. Возникает симптоматика и со стороны желудочно-кишечного тракта – резкое снижение аппетита, диспепсические расстройства (тошнота, изменение характера и частоты стула).
Железо – составная часть жизненно важных биологических комплексов, таких как гемоглобин (транспорт кислорода и углекислого газа), миоглобин (запасание кислорода в мышцах), цитохромы(ферменты). В организме взрослого человека содержится 4-5 г железа.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ:
- К.Н. Зеленин, В.П. Сергутин, О.В. Солод «Сдаем экзамен по химии отлично». ООО «Элбль-СПб», 2001 год.
- К.А.Макаров «Медицинская химия». Издательство СПбГМУ Санкт-Петербурга, 1996 год.
- Н.Л. Глинка «Общая химия». Ленинград «Химия», 1985 год.
- В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева «Химия. Тематические тесты для подготовки к ЕГЭ». Издательство «Легион», Ростов-на-Дону, 2012 год.
Валентность и степень окисления
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы

Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.

В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.

Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы — с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью — способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное понятие.

Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток — получает знак «+».

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉

Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Железо (Fe)
Соединения железа:
Железо является самым распространенным металлом в земной коре (5,1% по массе) после алюминия.
На Земле железо в свободном состоянии встречается в незначительных количествах в виде самородков, а также в упавших метеоритах.
Промышленным способом железо добывают на железнорудных месторождениях, из железосодержащих минералов: магнитного, красного, бурого железняка.
Следует сказать, что железо входит в состав многих природных минералов, обуславливая их природную окраску. Окраска минералов зависит зависит от концентрации и соотношения ионов железа Fe 2+ /Fe 3+ , а также от атомов, окружающих эти ионы. Например, присутствие примесей ионов железа влияет на окраску многих драгоценных и полудрагоценных камней: топазов (от бледно-желтого до красного), сапфиров (от голубого до темно-синего), аквамаринов (от светло-голубого до зеленовато-голубого) и проч.
Железо содержится в тканях животных и растений, например, в организме взрослого человека присутствует около 5 г железа. Железо является жизненно важным элементом, оно входит в состав белка гемоглобина, участвуя в транспортировке кислорода от легких к тканям и клеткам. При недостатке железа в организме человека развивается малокровие (железодефицитная анемия).
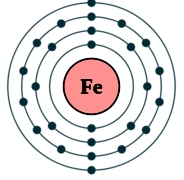
Рис. Строение атома железа.
Электронная конфигурация атома железа — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 6 электронов 3d-подуровня (всего 8 электронов), поэтому в соединениях железо может принимать степени окисления +8, +6, +4, +3, +2, +1, (наиболее часто встречаются +3, +2). Железо обладает средней химической активностью.
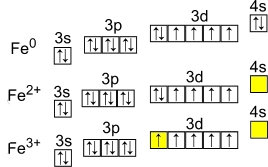
Рис. Степени окисления железа: +2, +3.
Физические свойства железа:
- металл серебристо-белого цвета;
- в чистом виде достаточно мягкий и пластичный;
- хобладает хорошей тепло- и электропроводимостью.
Железо существует в виде четырех модификаций (различаются строением кристаллической решетки): α-железо; β-железо; γ-железо; δ-железо.
Химические свойства железа
- реагирует с кислородом, в зависимости от температуры и концентрации кислорода могут образовываться различные продукты или смесь продуктов окисления железа (FeO, Fe2O3, Fe3O4):
3Fe + 2O2 = Fe3O4; - окисление железа при низких температурах:
4Fe + 3O2 = 2Fe2O3; - реагирует с водяным паром:
3Fe + 4H2O = Fe3O4 + 4H2; - мелко раздробленное железо реагирует при нагревании с серой и хлором (сульфид и хлорид железа):
Fe + S = FeS; 2Fe + 3Cl2 = 2FeCl3; - при высоких температурах реагирует с кремнием, углеродом, фосфором:
3Fe + C = Fe3C; - с другими металлами и с неметаллами железо может образовывать сплавы;
- железо вытесняет менее активные металлы из их солей:
Fe + CuCl2 = FeCl2 + Cu; - с разбавленными кислотами железо выступает в роли восстановителя, образуя соли:
Fe + 2HCl = FeCl2 + H2; - с разбавленной азотной кислотой железо образует различные продукты восстановления кислоты, в зависимости от ее концентрации (N2, N2O, NO2).
Получение и применение железа
Промышленное железо получают выплавкой чугуна и стали.
Чугун — это сплав железа с примесями кремния, марганца, серы, фосфора, углерода. Содержание углерода в чугуне превышает 2% (в стали менее 2%).
Чистое железо получают:
- в кислородных конверторах из чугуна;
- восстановлением оксидов железа водородом и двухвалентным оксидом углерода;
- электролизом соответствующих солей.
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс.
Доменная печь является очень сложным техническим сооружением высотой в несколько десятков метров. Она выкладывается из огнеупорного кирпича и защищается внешним стальным кожухом. По состоянию на 2013 год самая крупная доменная печь была построена в Южной Корее сталелитейной компанией POSCO на металлургическом заводе в городе Кванъян (объем печи после модернизации составил 6000 кубометров при ежегодной производительности 5 700 000 тонн).

Рис. Доменная печь.
Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс.
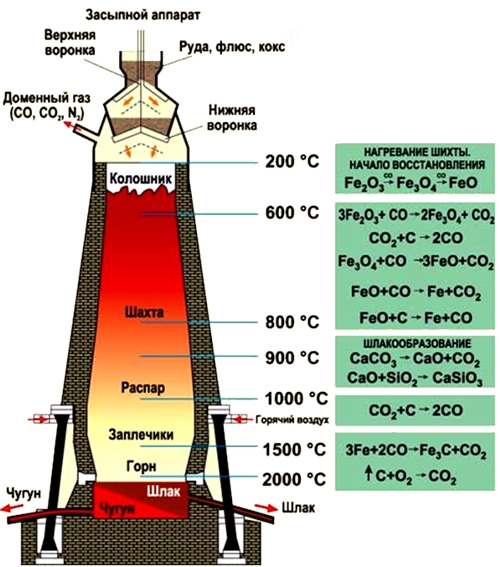
Рис. Процесс выплавки чугуна в доменной печи.
- обогащенные руды (магнитный, красный, бурый железняк) и кокс засыпаются через колошник, расположенный в самом верху доменной печи;
- процессы восстановления железа из руды под действием оксида углерода (II) протекают в средней части доменной печи (шахте) при температуре 450-1100°C (оксиды железа восстанавливаются до металла):
- 450-500°C — 3Fe2O3 + CO = 2Fe3O4 + CO2;
- 600°C — Fe3O4 + CO = 3FeO + CO2;
- 800°C — FeO + CO = Fe + CO2;
- часть двухвалентного оксида железа восстанавливается коксом: FeO + C = Fe + CO.
- параллельно идет процесс восстановления оксидов кремния и марганца (входят в железную руду в виде примесей), кремний и марганец входят в состав выплавляющегося чугуна:
- SiO2 + 2C = Si + 2CO;
- Mn2O3 + 3C = 2Mn + 3CO.
- при термическом разложении известняка (вносится в доменную печь) образуется оксид кальция, который реагирует с оксидами кремния и алюминия, содержащихся в руде:
- CaCO3 = CaO + CO2;
- CaO + SiO2 = CaSiO3;
- CaO + Al2O3 = Ca(AlO2)2.
- при 1100°C процесс восстановления железа прекращается;
- ниже шахты располагается распар, самая широкая часть доменной печи, ниже которой следует заплечник, в котором выгорает кокс и образуются жидкие продукты плавки — чугун и шлаки, накапливающиеся в самом низу печи — горне;
- в верхней части горна при температуре 1500°C в струе вдуваемого воздуха происходит интенсивное сгорание кокса: C + O2 = CO2;
- проходя через раскаленный кокс, оксид углерода (IV) превращается в оксид углерода (II), являющийся восстановителем железа (см. выше): CO2 + C = 2CO;
- шлаки, образованные силикатами и алюмосиликатами кальция, располагаются выше чугуна, защищая его от действия кислорода;
- через специальные отверстия, расположенные на разных уровнях горна, чугун и шлаки выпускаются наружу;
- бОльшая часть чугуна идет на дальнейшую переработку — выплавку стали.
Сталь выплавляют из чугуна и металлолома конверторным способом (мартеновский уже устарел, хотя еще и применяется) или электроплавкой (в электропечах, индукционных печах). Суть процесса (передела чугуна) заключается в понижении концентрации углерода и других примесей путем окисления кислородом.
Как уже было сказано выше, концентрация углерода в стали не превышает 2%. Благодаря этому, сталь в отличие от чугуна достаточно легко поддается ковке и прокатке, что позволяет изготавливать из нее разнообразные изделия, обладающие высокой твердостью и прочностью.
Твердость стали зависит от содержания углерода (чем больше углерода, тем тверже сталь) в конкретной марке стали и условий термообработки. При отпуске (медленном охлаждении) сталь становится мягкой; при закалке (быстром охлаждении) сталь получается очень твердой.
Для придания стали нужных специфических свойств в нее добавляют лигирующие добавки: хром, никель, кремний, молибден, ванадий, марганец и проч.
Чугун и сталь являются важнейшими конструкционными материалами в подавляющем большинстве отраслей народного хозяйства.
Биологическая роль железа:
- в организме взрослого человека содержится около 5 г железа;
- железо играет важную роль в работе кроветворных органов;
- железо входит в состав многих сложных белковых комплексов (гемоглобина, миоглобина, различных ферментов).
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе
