Жидкая двуокись углерода что это такое?
Углекислый газ: характеристики и применение

Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха. Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму. Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
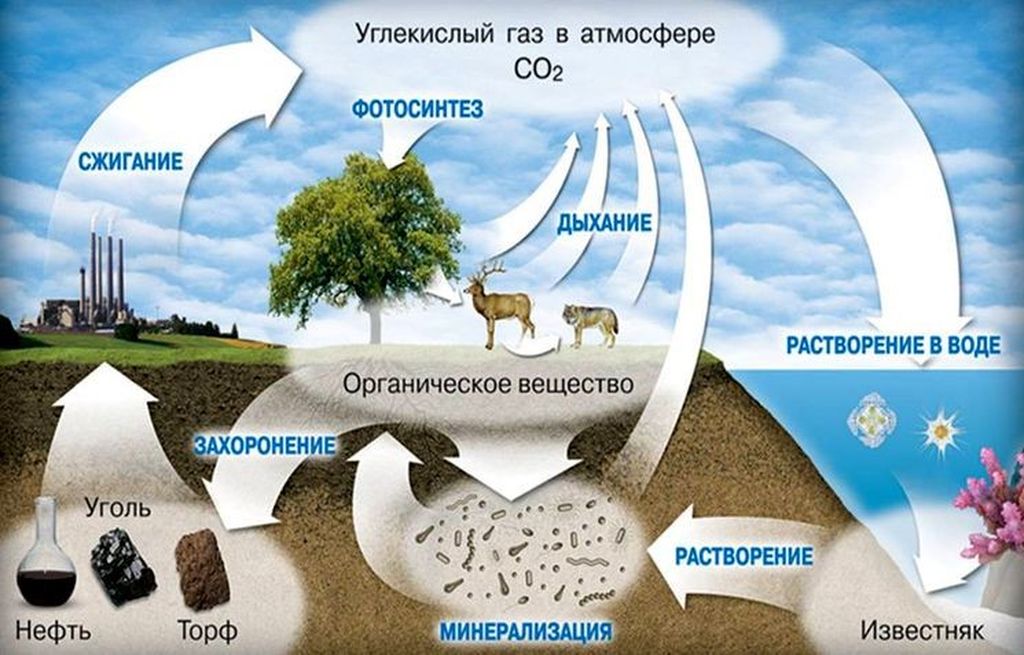
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий. Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
 Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной. По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей. При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности
 Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.
- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Жидкая углекислота

Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Содержание
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (
65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа. [1]
Примечания
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
См. также
Ссылки
Wikimedia Foundation . 2010 .
- Жидель Шарль Антуан
- Жидкий азот
Смотреть что такое «Жидкая углекислота» в других словарях:
УГЛЕКИСЛОТА — Ангидрид угольной кислоты ( Аcidum cаrbonicum аnhydricum ; Саrbonei dioxydum): СО 2 . Бесцветный газ без запаха. В 1,5 раза тяжелее воздуха. При давлении 60 атм может быть превращен в жидкость при обычной температуре. Жидкий угольный ангидрид по … Словарь медицинских препаратов
Углекислота — Диоксид углерода Другие названия углекислый газ, углекислота, сухой лед(твердый) Формула CO2 Молярная … Википедия
УГЛЕКИСЛОТА — (угольный ангидрид, двуокись углерода, углекислый газ, С02) была известна еще в 16 в. Парацельсу и ван Гель монту как составная часть воздуха и как продукт, образующийся при брожении, дыхании и т. д. У.»бесцветна, имеет слабый запах и слегка … Большая медицинская энциклопедия
Углекислота* — углекислый газ, угольный ангидрид, СО 2 вещество газообразное при обыкновенных условиях температуры и давления и сравнительно легко переходящее в жидкое и твердое состояние. Так как углекислота довольно легко получается в очень чистом виде и для… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Углекислота — углекислый газ, угольный ангидрид, СО 2 вещество газообразное при обыкновенных условиях температуры и давления и сравнительно легко переходящее в жидкое и твердое состояние. Так как углекислота довольно легко получается в очень чистом виде и для… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Acidum carbonicum anhydricum — УГЛЕКИСЛОТА . Ангидрид угольной кислоты ( Аcidum cаrbonicum аnhydricum ; Саrbonei dioxydum): СО 2 . Бесцветный газ без запаха. В 1,5 раза тяжелее воздуха. При давлении 60 атм может быть превращен в жидкость при обычной температуре. Жидкий… … Словарь медицинских препаратов
Углерод — (С, атомный вес 12) принадлежит к числу элементов, в значительной степени распространенных в природе. Входя в состав растительных и животных тканей (вместе с водородом, кислородом и азотом), У. играет важную роль во всех жизненных процессах… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Газы сжиженные и в критическом состоянии — Во времена Лавуазье (см. это имя) переход Г. в жидкое и твердое состояние казался весьма вероятным, так как при химических реакциях часто совершается подобная перемена физического состояния ( Oeuvres de Lavoisier , т. II 804). В начале XIX… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Оксид углерода(IV) — Оксид углерода (IV) … Википедия
Диоксид углерода — Другие названия углекислый газ, углекислота, сухой лед(твердый) Формула CO2 Молярная … Википедия
Двуокись углерода
Газообразный
Жидкий
Двуокись углерода (диоксид углерода, СО2) во всех своих состояниях широко используется практически во всех отраслях промышленности и агропромышленного комплекса.
На долю СО2 приходится 10 % всего рынка технических газов, что ставит этот продукт в один ряд с основными продуктами разделения воздуха.
Оксид углерода (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид, углекислота) — CO2, бесцветный газ, без запаха, со слегка кисловатымвкусом.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,038 %
Физические
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно изтвёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода длярастений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В пищевых целях используется газ, образующийся при спиртовом брожении. После предварительной обработки газ закачивается в баллоны.
Так же углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (
65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в ледниках. Жидкая углекислота используется в качестве хладагента и рабочего тела в теплоэнергетических установках (в холодильниках, морозильниках, солнечных электрогенераторах и т. д.).
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Углекислый газ в атмосфере
Изменения концентрации атмосферной углекислоты (кривая Килинга). Измерения на обсерватории Мауна-Лоа.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосысуши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемых топлив (угля, нефти, газа), заметно увеличивающееся в зимний сезон.
Углекислый газ (диоксид углерода)

Он не пригоден для поддержания жизни. Однако именно им «питаются» растения, превращая его в органические вещества. К тому же он является своеобразным «одеялом» Земли. Если этот газ вдруг исчезнет из атмосферы, на Земле станет гораздо прохладнее, а дожди практически исчезнут.
«Одеяло Земли»
Углекислый газ (двуокись углерода, диоксид углерода, CO2) формируется при соединении двух элементов: углерода и кислорода. Он образуется в процессе сжигания угля или углеводородных соединений, при ферментации жидкостей, а также как продукт дыхания людей и животных. В небольших количествах он содержится и в атмосфере, откуда он ассимилируется растениями, которые, в свою очередь, производят кислород.
Углекислый газ бесцветен и тяжелее воздуха. Замерзает при температуре −78.5°C с образованием снега, состоящего из двуокиси углерода. В виде водного раствора он образует угольную кислоту, однако она не обладает достаточной стабильностью для того, чтобы ее можно было легко изолировать.
Углекислый газ — это «одеяло» Земли. Он легко пропускает ультрафиолетовые лучи, которые обогревают нашу планету, и отражает инфракрасные, излучаемые с ее поверхности в космическое пространство. И если вдруг углекислый газ исчезнет из атмосферы, то это в первую очередь скажется на климате. На Земле станет гораздо прохладнее, дожди будут выпадать очень редко. К чему это в конце концов приведет, догадаться нетрудно.
Правда, такая катастрофа нам пока еще не грозит. Скорее даже, наоборот. Сжигание органических веществ: нефти, угля, природного газа, древесины – постепенно увеличивает содержание углекислого газа в атмосфере. Значит, со временем надо ждать значительного потепления и увлажнения земного климата. Кстати, старожилы считают, что уже сейчас заметно теплее, чем было во времена их молодости.
Двуокись углерода выпускается жидкая низкотемпературная, жидкая высокого давления и газообразная. Ее получают из отбросных газов производств аммиака, спиртов, а также на базе специального сжигания топлива и других производств. Газообразная двуокись углерода – газ без цвета и запаха при температуре 20°С и давлении 101,3 кПа (760 мм рт. ст.), плотность – 1,839 кг/м 3 . Жидкая двуокись углерода – просто бесцветная жидкость без запаха.
Углекислый газ нетоксичен и невзрывоопасен. При концентрациях более 5% (92 г/м 3 ) двуокись углерода оказывает вредное влияние на здоровье человека — она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Получение двуокиси углерода
В промышленности углекислый газ получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве газ закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
«Сухой лед» и прочие полезные свойства диоксида углерода
В повседневной практике углекислый газ используется достаточно широко. Например, газированная вода с добавками ароматных эссенций – прекрасный освежающий напиток. В пищевой промышленности диоксид углерода используется и как консервант — он обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Углекислотными огнетушителями пользуются при пожарах. Биохимики нашли, что удобрение. воздуха углекислым газом весьма эффективное средство для увеличения урожайности различных культур. Пожалуй, такое удобрение имеет единственный, но существенный недостаток: применять его можно только в оранжереях. На заводах, производящих диоксид углерода, сжиженный газ расфасовывают в стальные баллоны и отправляют потребителям. Если открыть вентиль, то из отверстия с шипением вырывается. снег. Что за чудо?
Все объясняется просто. Работа, затраченная на сжатие газа, оказывается значительно меньше той, которая требуется на его расширение. И чтобы как-то компенсировать возникающий дефицит, углекислый газ резко охлаждается, превращаясь в «сухой лед». Он широко используется для сохранения пищевых продуктов и перед обычным льдом имеет значительные преимущества: во-первых, «хладопроизводительность» его вдвое выше на единицу веса; во-вторых, он испаряется без остатка.
Углекислый газ используется в качестве активной среды при сварке проволокой, так как при температуре дуги углекислота разлагается на угарный газ СО и кислород, который, в свою очередь, и входит во взаимодействие с жидким металлом, окисляя его.
Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Диоксид углерода
Диоксид углерода (пищевая добавка E290, углекислота) — химическое соединение бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2. Плотность приблизительно в 1,5 раза выше, чем у воздуха; в 1 л воды при комнатной температуре растворяется около 1 л углекислоты. Содержится в воздухе (0,03 % по объёму) и в водах минеральных источников. Добавка Е290 относится к разрыхлителям, регуляторам кислотности и консервантам искусственного происхождения, используется в технологических целях в процессе производства пищевых продуктов для увеличения длительности хранения. Широко применяется в пищевой промышленности.
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать CO2, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа.
Применение
Пищевая добавка Е290 применяется в производстве газированных напитков, в составе разрыхлителя для теста, выпечки и кондитерских изделий, при заморозке свежих продуктов, мороженного.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений.
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см 2 ). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см 2 ), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Польза и вред
Е290 считается нетоксичным (4 класс опасности ГОСТ 12.1.007), но при вдыхании диоксида углерода в повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам.
Незначительные повышения концентрации, вплоть до 2–4 %, в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7–10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией.
Несмотря на то, что даже концентрация 5–7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO2 существенно влияет на самочувствие человека.
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия.
Особые указания
Добавка Е290 одобрена для использования в большинстве стран мира, включая Россию и Украину.
Диоксид углерода входит в список пищевых добавок, допустимых к применению в пищевой промышленности Российской Федерации в качестве вспомогательного средства для производства пищевой продукции (п.2.25.2 СанПиН 2.3.2.1293-03).
Поделиться этой страницей
Подробнее по теме
Ознакомьтесь с дополнительной информацией о действующем веществе Диоксид углерода:
